Ձվարանների խթանում պրոգեստինով ԱՄԲ ծրագրերում դոնորական ձվաբջիջներով
Դիանա Մարտիրոսյան1, Էդուարդ Համբարձումյան1,2
1Պտղաբերության կենտրոն «Fertility Center»
2Առողջապահության ազգային ինստիտուտ, Մարդու վերարտադրողականության ամբիոն (Երևան, ՀՀ)
Ամփոփագիր
Պրոգեստինով խթանվող ձվարանների խթանման (PPOS) գործելակարգը ձվարանների խթանման ժամանակակից սխեմաներից մեկն է վերարտադրողական օժանդակ տեխնոլոգիաներում (ART): PPOS-ի հիմնական նպատակը ձվարանների խթանման ընթացքում վաղաժամ լյուտեինացնող հորմոնի (LH) արտազատման կանխումն է, որը ձեռք է բերվում պրոգեստինների օգտագործմամբ՝ ավանդական գոնադոտրոպին-ազատող հորմոնի (GnRH) ներհակորդների փոխարեն: PPOS-ը կիրառվում է ինչպես ստանդարտ ԱՄԲ ցիկլերի, այնպես էլ ձվաբջջի դոնորության ծրագրերի համար։ Մեր ուսումնասիրության արդյունքում պարզվել է, որ այս գործելակարգը ապահովում է բարձր արդյունքներ՝ կապված հասուն ձվաբջիջների քանակի և որակի հետ: Մենք ուսումնասիրել ենք LH-ի, E2-ի և P4-ի մակարդակների դինամիկան ձվաբջիջների դոնորների խթանման ժամանակ։ Ուսումնասիրության արդյունքները ցույց տվեցին, որ պրոգեստինները արդյունավետ միջոց են վաղաժամ LH արտանետումը կանխելու համար: Նաև հայտնաբերեցինք, որ պրոգեստինները ոչ միայն կանխում են LH արտանետումը ձվարանների խթանման նախաօվուլյատոր օրերին, այլև հանգեցնում են ինչպես LH-ի, այնպես էլ P4-ի մակարդակների զգալի նվազման (p<0.05): Բացի դրանից, պրոգեստինների օգտագործումը ԱՄԲ և ձվաբջջի դոնորության ծրագրերում չի նվազեցնում էմբրիոլոգիական ցուցանիշները ձվարանների պունկցիայից հետո, ինչի վկայությունն են ձվաբջիջների բեղմնավորման բարձր ցուցանիշները (74%) և բլաստուլյացիայի հաճախականությունը (61%): PPOS-ի առավելություններից են պրոգեստինների ցածր գինը, ինչպես նաև այն, որ հիվանդները կարիք չունեն GnRH ներհակորդների ամենօրյա ներարկումների, ինչը մեծացնում է գոհունակությունն ու հարմարությունը: Այսպիսով, PPOS գործելակարգը ներկայացնում է ձվարանների խթանման ավանդական սխեմաների արդյունավետ և անվտանգ այլընտրանք ձվաբջջի դոնորության և ԱՄԲ ծրագրերում:
DOI 10.54235/27382737-2024.v4.2-67
Использование вспомогательных репродуктивных технологий (ВРТ) значительно увеличилось за последнее десятилетие, став важной частью современной медицины и играя ключевую роль в планировании семьи для многих людей.
Протоколы, используемые для индукции овуляции во время вспомогательных репродуктивных процедур, направлены на получение как можно большего количества яйцеклеток для оптимизации шансов на успех лечения. Протокол стимуляции яичников прогестином — это инновационный подход в области женской репродуктивной медицины. Согласно некоторым клиническим исследованием, стимуляция яичников прогестином обеспечивает аналогичный исход беременности, как и обычные протоколы [1-4]. Прогестины считаются новым альтернативным агентом для подавления преждевременного подъёма ЛГ во время СЯ улучшая результаты стимуляции яичников [5]. При отсутствии гипофизарной супрессии преждевременные всплески ЛГ наблюдались более чем в 20% циклов стимуляции яичников. Как правило, антагонисты или агонисты гонадотропин-рилизинг гормона (GnRH) также включаются, чтобы избежать раннего пика лютеинизирующего гормона (ЛГ) и следовательно, овуляции до сбора яйцеклеток. Традиционно использование таких препаратов считалось удовлетворительным для выполнения этой функции, хотя оно сопряжено с высокими затратами для пациента и вызывает дискомфорт, связанный с инъекционным путем введения. В отличие от аналогов ГнРГ, применение прогестина для подавления ЛГ связано с преимуществами перорального приема, удобством использования и низкой стоимостью [6]). Механизм подавления ЛГ прогестинами до сих пор полностью не выяснен, но считается, что он уменьшает пульсацию ГнРГ из гипоталамуса, тем самым ингибируя высвобождение ЛГ, связанное с повышением уровня эстрадиола [7]. Одним из ключевых преимуществ PPOS является значительно сниженный риск развития синдрома гиперстимуляции яичников (СГЯ). На текущем этапе развития ВРТ, когда замораживание эмбрионов становится все более распространенной практикой и дает хорошие результаты, можно рассматривать новые варианты контроля пика ЛГ и подавления овуляции. В связи с этим использование прогестинов считается альтернативным методом подавления овуляции и вызвало большой интерес, а возможное негативное воздействие на эндометрий больше не вызывает беспокойства, поскольку теперь перенос эмбрионов можно осуществить в следующий цикл [1-3, 8].
Цель
Цель настоящего исследования — изучить эффективность и безопасность применения прогестинов в программах ЭКО для доноров яйцеклеток. В задачу данного исследования входило определить эффективность, безопасность, а также соотношение цена/качество применения прогестинов в программах стимуляции яичников вместо антагонистов. Мы также проанализировали эмбриологические параметры программы ЭКО.
Материал и методы
В настоящем исследовании проведен анализ 84 циклов ЭКО в программах с донорской яйцеклеткой, проведенных в центре «Fertility Center», в которых вместо аналогов ГнРГ использовали прогестины.
Пациенты исследованной группы составили 58 женщин в возрасте от 20 до 34 лет. Стимуляция согласно протоколам клиники [9], начиналась на 2–3 день менструального цикла (Рис 1). Всем женщинам с началом стимуляции яичников одновременно с гонадотропинами (ФСГ 225 ME в сутки, п/к) назначали дидрогестерон в дозе 20 мг/день (Дюфастон) и продолжали до дня триггера. Уровень гормонов (Е2, ЛГ, Прогестерон) контролировался с помощью анализа крови в первый день стимуляции, на 7–8 день стимуляции, а также в день триггера овуляции. В качестве триггера использовался декапептил 0,3 мг п/к. Через 36 часов после достижения 1-го или 2-х фолликулов в размере диаметре 18 мм и более проводилась пункция яичников. Заморозка эмбрионов проводилась на 3-ий или 5-ый дни методом витрификации в соответствии с протоколами клиники “Freeze all”.
Основные параметры, которые были оценены: эффективность применения прогестинов определялась по его способности снижения уровня гонадотропина (ЛГ) в пред овуляторном периоде и подавлении преждевременных овуляций. Мы учитывая также среднюю продолжительность стимуляции яичников, средняя доза использованных гонадотропинов, а также расходы на медикаменты. Качество яйцеклеток определялись по уровню гормонов яичников (Пг, Е2) в материнской крови (косвенный показатель), общему количеству полученных после пункции яйцеклеток, из них процент зрелых MII ооцитов, индекс оплодотворения ооцитов, уровень формирования бластоцист, индекс имплантации.
Результаты
58 донорам ооцитов порведено 84 циклов ЭКО.
Результаты наших исследований представлены в Таблице 1.
Как показывает анализ результатов, уровень ЛГ в крови на протяжении стимуляции яичников не только не повышается, но и статистически достоверно понижается, что свидетельствует об эффективности ингибирования прогестинами синтеза ЛГ гипофизом в преовуляторной период стимуляции яичников. Об этом же свидетельствует тот факт, что в наших исследованиях не было зафиксировано ни одного случая преждевременной овуляции. Побочные эффекты, связанные с использованием дидрогестерона, так же, как и осложнения в процессе стимуляции яичников (СГЯ) или в течение всей программы ЭКО, не наблюдались. Больные также отмечали удобства и более легкую переносимость перорального препарата Дюфастон по сравнению с ежедневными инфекциями антагонистов. Следует отметить, что стоимость перорального прогестина на курс (3100±250 дрaмов) значительно ниже стоимости антагонистов ГнРГ, только одна ампула которого (например, Цетротида, стоимостью в 32 000 драмов), уже в разы дороже использованных нами прогестинов.
О качестве полученных яйцеклеток можно судить косвенно по высоким уровням эстрогенов (что свидетельствует о функциональной зрелости фолликулов) и отсутствию признаков преждевременной лютеинизации кумулюсного комплекса (низкие уровни ЛГ и прогестерона). Об этом же говорят также количественные и морфологические показатели полученных яйцеклеток и эмбрионов. Как видно из Таблицы 1 нами было получило 633 ооцита, из которых зрелых ооцитов (MII) было 500 (78,9%), 100 MI (15,7%) 33 GV ( 5,2%). Указанные данные статистически не разнятся от данных литературы и показателей, полученных в протоколах антагонистов ГнРГ в нашей клинике (данные не приведены). В результате оплодотворения мы получили 305 бластоцист, что составляет 61% бластуляции. Этот показатель, наряду с высоким процентом полученных бластоцист хорошего качества, также указывает на эффективность использования прогестинов в циклах ЭКО. В настоящее время мы проводим проспективное исследование с участием более широкой популяции женщин, включенных в программу ЭКО с применением прогестинов, а также контрольной группы, использующей протокол с антагонистами ГнРГ. Основными показателями исследования выбраны количество живорождений и частота патологий беременности.
Заключение
Таким образом, результаты наших исследований показали, что стимуляция яичников с использованием прогестинов может рассматриваться как более доступная и удобная альтернатива в протоколах стимуляции, когда не планируется свежий перенос эмбриона. Продолжающиеся исследования и клинический опыт подтверждают её преимущества, делая PPOS привлекательным выбором для программ экстракорпорального оплодотворения. Основным преимуществом этого протокола является эффективная профилактика преждевременного подъема уровня ЛГ во время стимуляции яичников. Подробный анализ эмбриологических показателей свидетельствует об эффективности применения данного метода в программах ЭКО. Прогестины также обеспечивают дополнительные выгоды: отсутствие необходимости в инъекциях и уменьшение числа визитов к врачу, значительное снижение финансовых затрат. Для подтверждения эффективности и безопасности применения прогестинов в процессе стимуляции яичников необходимы дальнейшие рандомизированные контролируемые исследования, где основными результатами будут частота живорождения здоровых детей, частота наступления беременности и частота осложнений во время беременности.
Список литературы
- Progestin-primed ovarian stimulation protocol for patients in assisted reproductive technology, https://www.ncbi.nlm.nih.gov/pmc/articles/pmc8438422/ (18.09.2024)
- Progestin-primed ovarian stimulation: for whom, when and how?, https://www.rbmojournal.com/article/s1472-6483(23)00738-1/fulltext#:~:text=progestin%2dprimed%20ovarian%20stimulation%20(ppos,releasing%20hormone%20(gnrh)%20analogues (18.09.2024)
- Oral medroxyprogesterone acetate for the use of ovulation suppression in in vitro fertilization: a cohort trial, www.fertstert.org/article/s0015-0282(24)00029-3/abstract (18.09.2024)
- Kuang Y., Hong Q., Lyu Q., Ai A., Fu Y., Yan Z., Wang L., et al. (2015). Progestin-primed ovarian stimulation (PPOS) for preventing premature LH surge in assisted reproduction: a novel protocol. Clinical Endocrinology, 82(5), 747-753.
- Massin N. (2017). New stimulation regimens: Endocrine responses and clinical outcomes. Fertility and Sterility, 108(4), 588-594.
- Zhu X., Ye H., Fu Y., Lyu Q., Kuang Y. (2019). Progestin-primed ovarian stimulation protocol as an alternative for patients with ovarian insufficiency. Journal of Ovarian Research, 12(1), 64.
- Chen Q., Chai W., Wang Y., Cai R., Zhang S., Lu X., Wang L., Kuang Y. (2020). Comparison of progestin-primed ovarian stimulation with a flexible GnRH antagonist protocol in infertile women: A large retrospective cohort study. Reproductive Biology and Endocrinology, 18, 88.
- Huang B., Ren X., Wu L., Zhu L., Xu B., Li Y., Ai J., Jin L. (2017). Progestin-primed ovarian stimulation protocol is effective and safe for normal responders in in vitro fertilization. Medicine (Baltimore), 96(9), e6097.
- Амбарцумян Э. Экстракорпоральное оплодотворение в деталях. Издательство Зангак, Ереван. 2024, с 273.
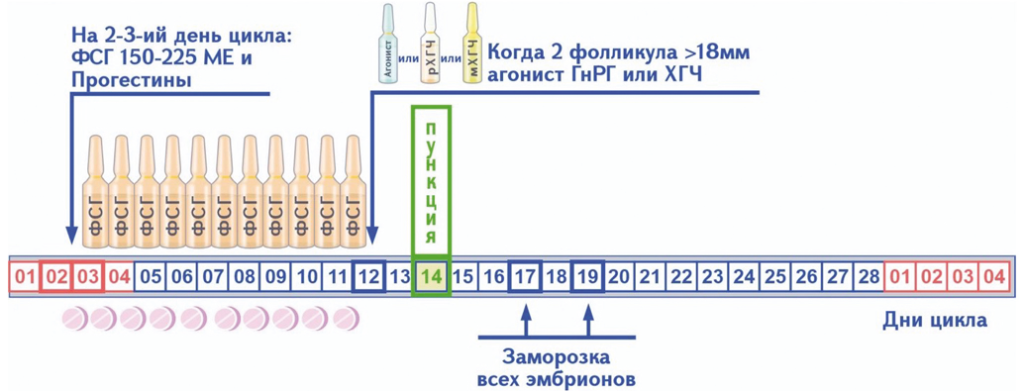
Рисунок 1. Протокол стимуляции яичников с использованием прогестинов.
Со 2-го дня цикла назначаются препараты, содержащие ФСГ, в обычных дозах (225 ME в сутки), вместе с прогестинами (Дюфастон 20мг, per os), триггер овуляции производится агонистами ГнРГ (Декапептил 0,3мг), когда размер одного или двух фолликулов достигал 18 мм в диаметре.
Таблица 1. Эффективность и безопасность, а также эмбриологические показатели донорских программ ЭКО с применением прогестинов во время стимуляции яичников.
| Популяция доноров | Показатель | Величина Р(там, где применимо) |
| Клинические и лабораторные показатели | ||
| Антимюллеров гормон (нг/мл) (ссредняя ± СД) | 4,8±1.3 | |
| Уровень ЛГ в крови (mIU/ml): (средняя ± СД)— в первый день стимуляции:-на 7-8 день стимуляции:-в день триггера овуляции: | 6.5±2.63.6±2.02.3±1.7* | P=0.000, (P<0.05) |
| Уровень Е2 в крови (пг/мл): (средняя ± СД)— в первый день стимуляции:-на 7-8 день стимуляции:-в день триггера овуляции: | 31.56±9.72007.8±1010.52953.4±192.3* | P=0.000, (P<0.05) |
| Уровень Пг в крови (нг/мл): (средняя ± СД)— в первый день стимуляции:-на 7-8 день стимуляции:-в день триггера овуляции: | 0.33±0.20.52±0.30.99±0.6* | P=0.000, (P<0.05) |
| Количество преждевременных овуляций (n) | 0 | |
| Стоимость использованного препарата Дюфастона в течение всей стимуляции яичников (в драмах) | 3100±250 | |
| Количество осложнений:Лекарственная аллергияСиндром гиперстимуляции яичников | 00 | |
| Эмбриологические параметры | ||
| Количество аспирированных ооцитов (n) | 633 | |
| Частота зрелых ооцитов (%). Частота зрелых ооцитов= Количество зрелых (MII) ооцитов /Общее количество ооцитов/ ×100 | 78,9 | |
| Частота оплодотворения (%). Общее количество оплодотворенных ооцитов/Количество зрелых (MII) ооцитов×100 | 71 | |
| Частота бластуляции (%). Количество бластоцист /Количество оплодотворенных ооцитов ×100 | 61 | |
*Соотношение показателя в день триггера по отношению к первому дню стимуляции