Possibilities of using modern visualization methods of the lymphatic system in plastic surgery
Literature review
Karen A. Petrosyan, Paruyr A. Antonyan, Angin A. Khachatryan
Department of Plastic and Reconstructive Surgery, Avdalbekyan National Institute of Health, Yerevan, Armenia
ABSTRACT
Lymphatic system (LS) visualization methods which are safe and satisfy the requirements of clinicians are very crucial. Currently, more sensitive devices appear and new methods have been introduced. This paper provides a comprehensive analysis of the main existing methods of LS visualization, indicating the possibilities of application in clinical and experimental conditions, presenting the advantages and disadvantages of the methods. There are two groups of LS visualization methods in general: direct or invasive (lymphangioscintigraphy) and indirect or minimally invasive (magnetic resonance, radionuclide, ultrasound, fluorescence). The features of the methods are: sensitivity, extension, specificity, and depth of penetration into tissues. This literature review gives a description of contrast agents and methods through which it is possible to visualize the dynamic status of lymphatic drainage and determine the localization of sentinel lymph nodes. We describe the most acceptable visualization method for use in plastic surgery to lower the rate of complications such as edema, bruising and inflammation.
Keywords: lymphatic system, lymph flow, fluorescence imaging, indocyanine green, magnetic resonance imaging, single-photon emission computed tomography, positron emission tomography.
DOI 10.54235/27382737-2022.v2.2-30
ՆԵՐԱԾՈՒԹՅՈՒՆ
Ավշատար/լիմֆատիկ համակարգը (ԱՀ) կարևոր դեր է խաղում միկրոշրջանառության, բորբոքային գործընթացների ախտածագության մեջ [1,2], ինչպես նաև հետվիրահատական բարդությունների կանխարգելման գործում։ Մի շարք ճանաչված պլաստիկ վիրաբույժներ իրենց աշխատանքներում բազմիցս շեշտում են դեղորայքի կարևոր դերը նորմայում և պաթոլոգիայում, ինչպես նաև նշում են, որ լիմֆոդրենաժի վնասման կանխարգելումը հաջող վիրահատության գործոններից մեկն է [3-7]: Հայտնի ավստրալացի անատոմ Վ. Պանը նշում է, որ ԱՀ-ի անատոմիայի ժամանակակից գիտելիքները չեն համընկնում կամ չեն բացատրում որոշ անսպասելիորեն բացահայտված կլինիկական տվյալներ և ընդգծում է հետագա հետազոտությունների անհրաժեշտությունը [8]:
ԱՀ-ի հայտնաբերումը վերագրվում է իտալացի անատոմ Գասպարո Ասելիին (1627 թ.) [9], իսկ Ա. Նուկը 1692 թ. սկսեց դիակների վրա իրականացնել ԱՀ-ի ուսումնասիրություններ՝ օգտագործելով սնդիկի ներարկումներ [10]։
Ֆրանսիացի անատոմ Մ.Ֆ.Կ. Սապպեյը, օգտագործելով Նուկի տեխնիկան, 1874 թ. տրամադրեց մարդու ԱՀ-ի մանրամասն քարտեզագրումը [11]։ Նա առաջին անատոմն է, որն առաջարկել է մաշկը տարածքների բաժանելու հայեցակարգը՝ հաշվի առնելով առանձին տարածքների լիմֆոդրենաժը։
ԱՀ-ի ուսումնասիրության հաջորդ մեծ քայլը 1952 թ. բրիտանացի վիրաբույժ Ջ. Կինմոնթի կողմից ավշանոթագրության/լիմֆանգիոգրաֆիայի մեթոդի մշակումն էր [12]:
Եվ չնայած վերջին հարյուրամյակի անհերքելի առաջընթացին և ԱՀ-ի տեսապատկերման նորանոր մեթոդների ներդրմանը, լիմֆոդրենաժի վերաբերյալ գրաֆիկորեն ներկայացված տվյալները շատ դեպքերում պահակային ավշային հանգույցների (ՊԱՀ) մասին տվյալներ են, և չկան լիովին բավարար տվյալներ ԱՀ-ի կառուցվածքի վերաբերյալ [13]:
Մ.Ա. Սոտո-Միրանդան և համահեղ. (2013) կատարել են լայնածավալ անատոմիական և կլինիկական հետազոտություններ և նոր տեղեկություններ տրամադրել ԱՀ-ի անատոմիայի և ֆունկցիայի մասին՝ ընդգծելով տեսապատկերման տեխնիկայի կատարելագործման անհրաժեշտությունը [14]։
ԱՀ-ն ավշատար անոթներից, ավշահանգույցներից և ավշային օրգաններից բաղկացած բարդ ցանց է։ Աշվային ցանցի վերաբերյալ խորը հետազոտական տվյալներ են պահանջվում ոչ միայն յատրոգեն վնասվածքները կանխելու համար՝ ուղղված հետվիրահատական բարդությունները կանխելուն, այլ նաև բարորակ և չարորակ հիվանդությունների բուժման համար: Ներկայումս ԱՀ-ի աշխատանքի հիմնական մեխանիզմներն ու կառուցվածքային առանձնահատկությունները հասկանալու համար դեռևս կան սահմանափակումներ: Տվյալների պակասը սահմանափակում է բժշկին ԱՀ-ի ֆունկցիայի տարբեր խանգարումների բուժման մեջ, ինչպես նաև չարորակ նորագոյացությունների դեմ պայքարելու հնարավորությունները, որտեղ կարևոր դեր է խաղում մետաստազների վերահսկումը [15]: Մակերեսային ավշատար անոթները տրամագծով շատ ավելի փոքր են, քան մաշկային երակները և մոտ 0,2-1,0 մմ տրամաչափի են։ Ավշատար անոթի պատը բարակ է և բաղկացած է էպիթելային բջիջների մեկ շերտից, շրջապատված հիմային թաղանթով և հարթ մկանային բջիջների երկու-երեք շերտով [16]: Ավիշը, ի տարբերություն արյան, անգույն է, և առանց ներկելու վիրահատության ընթացքում ավշատար անոթների նույնականացումը բարդ խնդիր է, և սահմանափակ տվյալների պատճառներից մեկը in vivo պայմաններում տեսապատկերման հասանելի և արդյունավետ տեխնիկայի բացակայությունն է [17]:
ԱՀ-ի վիճակը գնահատելու համար օգտագործվում են տեսապատկերման տարբեր մեթոդներ: Նախկինում օգտագործված մեթոդները, ինչպիսիք են լիմֆանգիոգրաֆիան, ներկային լիմֆոգրաֆիան, լիմֆոսցինտիգրաֆիան, համակարգչային շերտագրությունը (ՀՇ) և ուլտրաձայնային հետազոտությունը (ՈւՁՀ), չեն կարողանում լիովին բավարարել բոլոր կլինիկական պահանջները [18]:
Վերջերս ներդրվել են նոր մեթոդներ, ինչպիսիք են մագնիսառեզոնանսային շերտագրությունը (ՄՌՇ, MRI), 18-ֆտորդեզօքսիգլյուկոզային պոզիտրոն-էմիսիոն ՀՇ-ն (18-ՖԴԳ ՊԷՇ/ՀՇ, 18-FDG PET/CT), միաֆոտոն էմիսիոն ՀՇ-ն (ՄՖԷՀՇ, SPECT), կոնտրաստով ուժեղացված ՈւՁՀ (ԿՈւՁՀ, CEUS) և մերձինֆրակարմիր սպեկտրոսկոպիայի (ՄԻԿՍ, NIR) պատկերման համակարգ՝ օգտագործելով ինդոցիանին կանաչ (ԻՑԿ, ICG) մարկեր:
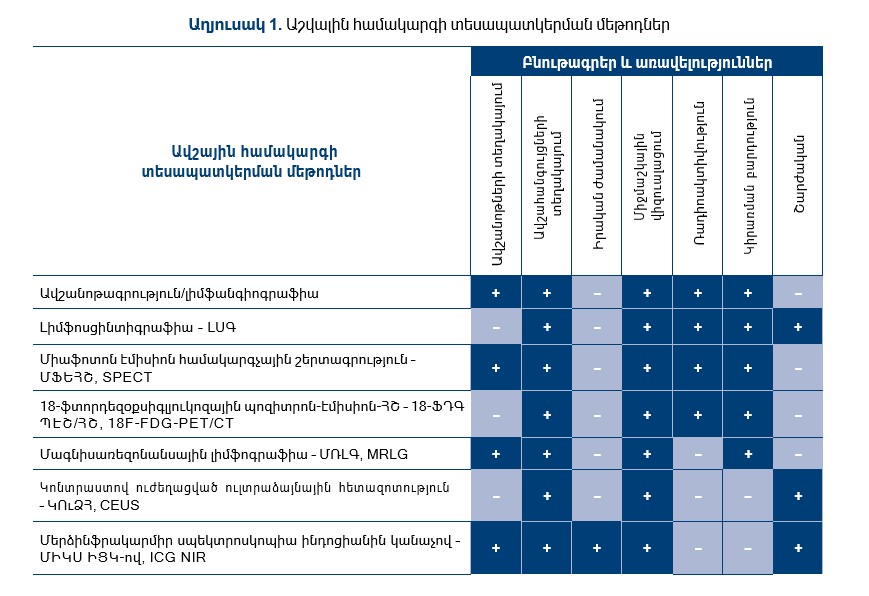
Սույն աշխատությունում վերլուծվել են գոյություն ունեցող մեթոդների առավելություններն ու թերությունները, և գրականության տվյալների քննադատական վերլուծության արդյունքում ստեղծվել է աղյուսակ, որը ցույց է տալիս մեթոդների ցուցիչները և բնութագրերը:
ԱՎՇԱՅԻՆ ՀԱՄԱԿԱՐԳԻ ՊԱՏԿԵՐՄԱՆ ՄԵԹՈԴՆԵՐ
ԱՀ-ի պատկերման մեթոդները կարելի է բաժանել երկու խմբի՝ ուղղակի կամ ինվազիվ և անուղղակի կամ նվազագույն ինվազիվ [19]:
Լիմֆանգիոգրաֆիայի ուղղակի, ինվազիվ մեթոդներ
Լիմֆանգիոգրաֆիա (ավշանոթագրություն). կոնտրաստանյութը ներարկվում է ուղղակիորեն ավշանոթների մեջ, ինչը հիմնական տարբերությունն է ԱՀ-ի պատկերման անուղղակի մեթոդների համեմատ: Ներարկվող կոնտրաստը կարող է մնալ օրգանիզմում մի քանի ամսից մինչև մի քանի տարի, ինչը թույլ է տալիս երկարաժամկետ հետևել, բայց կրկնակի ներարկումներն անհնարին է դարձնում: Ավշանոթների պունկցիայի տեխնիկական բարդության, ինչպես նաև մի քանի հազվագյուտ, բայց կյանքին սպառնացող բարդությունների առկայության պատճառով, ինչպիսին է ինդուկցված կոնտրաստային նեֆրոպաթիան [20], ուղղակի լիմֆանգիոգրաֆիան կլինիցիստների շրջանում դառնում է չպահանջված:
Լիմֆոգրաֆիայի անուղղակի/նվազագույն ինվազիվ մեթոդներ
Անուղղակի մեթոդները ներառում են մեթոդներ, երբ կոնտրաստանյութը կամ ներկը հոսում է ավշաանոթներ ինտերստիցիալ ներարկումից հետո: Անուղղակի լիմֆոգրաֆիան տեխնիկապես հեշտ է իրականացնել, չի պահանջում մեծ ծախսեր, ժամանակ և հետագա լրացուցիչ միջամտություններ։ Բացի այդ, մեթոդի կիրառումը առանց յոդացված կոնտրաստների օգտագործման թույլ է տալիս խուսափել կողմնակի երևույթներից: Գոյություն ունեն նվազագույն ինվազիվ լիմֆոգրաֆիայի մի շարք մեթոդներ, որոնք տարբերվում են տեխնիկական առանձնահատկություններով ԱՀ կառուցվածքների հայտնաբերման և վիզուացման գործում։
Նվազագույն ինվազիվ մեթոդները բաժանվում են խմբերի ռենտգենյան ճառագայթների օգտագործմամբ կամ առանց դրանց: Նաև այն կարելի է բաժանել ըստ հետազոտման ժամանակ կտրվածքի անհրաժեշտության: Լիմֆոսցինտիգրաֆիա (ԼՍԳ). ԱՀ-ի տեսապատկերման ամենալայն կիրառվող նվազագույն ինվազիվ մեթոդն է: Մեթոդի սկզբունքը ռադիոակտիվ ինդիկատորների ներդրումն է և վերջիններիս հայտնաբերումը արտաքին ճառագայթման դետեկտորների միջոցով։ Առավել հաճախ օգտագործվող մարկերը 99մ-տեխնեցիումն է (99mTc), որն ունի համեմատաբար կարճ կիսաքայքայման պարբերություն (6 ժամ) և արտանետում է ցածր էներգիայի ֆոտոններ [21]: Ուսումնասիրվող օբյեկտը դիտարկելու համար պատկերը նախագծվում է երկչափ (2D) տարածության մեջ: Ռադիոակտիվ ինդիկատորների կլանումը տեղի է ունենում ավելի ֆիզիոլոգիական եղանակով, համեմատած ուղղակի լիմֆանգիոգրաֆիայի հետ, ինչպես նաև ավշանոթների ուղղակի վնասում չի լինում, միջամտությունը հեշտ է կրկնել, իսկ զգայունությունը շատ ավելի բարձր է [22]: Այնուամենայնիվ, պատկերի լուծաչափը համեմատաբար ցածր է, և ավշանոթների ու հանգույցների ճշգրիտ գտնվելու վայրը դժվար է որոշել մշուշոտ 2D պատկերների պատճառով: Կա նաև ճառագայթման վտանգ, որը պահանջում է ճառագայթային պաշտպանության հատուկ միջոցներ և թափոնների հատուկ կառավարում: Ամփոփելով՝ կարելի է ասել, որ ժամանակակից կլինիկական պրակտիկայում ԱՀ-ի տեսապատկերման ներկայիս պահանջները հաշվի առնելով՝ մեթոդն ունի մի շարք սահմանափակումներ, սակայն չնայած դրան՝ ԼՍՑ-ն դեռևս կարևոր մեթոդ է ավշայտուցի/լիմֆեդեմայի ախտորոշման համար: Միաֆոտոն-էմիսիոն ՀՇ (ՄՖԷՀՇ, SPECT). տվյալներ է տրամադրում եռաչափ (3D) տարածության մեջ: Չնայած այն հանգամանքին, որ մեթոդն ավելի շատ տեղեկատվություն է տալիս, քան ԼՍՑ-ն, ըստ գրականության, դրա տարածական լուծաչափը բավարար չէ (1-2 սմ) [23] և չի կարող մանրամասն պատկերացում կազմել ԱՀ-ի անատոմիական կառույցների մասին [24]: SPECT-ը բարելավել է ՊԱՀ-երի տեսապատկերումը, սակայն ճառագայթումը պոտենցիալ սահմանափակում է դրա հետագա օգտագործումը: 18-ֆտորդեզօքսիգլյուկոզային պոզիտրոն-էմիսիոն ՀՇ (18-ՖԴԳ ՊԷՇ/ՀՇ, 18F-FDG PET/CT). ՊԷՇ-ը վիզուալացնում է գլյուկոզի նյութափոխանակության ակտիվությունը, վերլուծելով պոզիտրոնների ինտենսիվությունը, և կարող է հայտնաբերել մետաստազները նորմալ չափի հանգույցներում: Չարորակ բջիջների մեծ մասը տարբերվում է բարորակներից գլիկոլիզի բարձր արագության մակարդակով: Թեև որոշ չարորակ տեսակներ բնութագրվում են նյութափոխանակության նորմալ կամ ցածր արագությամբ [25], մեթոդի հիմնական սահմանափակումը պատկերի համեմատաբար ցածր տարածական լուծաչափն է [26]: ՀՇ-ինտեգրված ՊԷՇ-ը հաղթահարում է այս թերությունը՝ լրացնելով ՊԷՇ-ի ֆունկցիոնալությունը բարձր լուծաչափով ՀՇ պատկերներով: Արդյունքում, 18F-FDG-PET/CT-ն ավելի ճշգրիտ է ավշահանգույցների պատկերման համար, քան այս մեթոդներն առանձին-առանձին [27]: Վերջին նախակլինիկական հետազոտություններում 18F-FDG-PET-ը զուգակցվել է ՄՌՇ-ի հետ [28], որն ապահովում է փափուկ հյուսվածքների պատկերի բարձր տարածական լուծաչափ (3 մմ) առանց ճառագայթման ազդեցության: Տեխնիկայի այս համադրությունը խոստումնալից է և կարող է մեծ ազդեցություն ունենալ ավշահանգույցների պատկերման ապագայի վրա: Մեթոդը մնում է խոստումնալից չարորակ հիվանդությունների ախտորոշման գործում, սակայն սահմանափակվում է ավշահանգույցների տեսապատկերմամբ և չի տրամադրում տվյալներ լիմֆոդրենաժի վերաբերյալ: Եվ հաշվի առնելով մեթոդների համադրության տեխնիկական բարդությունը և բարձր արժեքը, այն հարմար չէ վերը նշված խնդիրները լուծելու համար: Մագնիսառեզոնանսային լիմֆոգրաֆիա (ՄՌԼԳ, MRLG). տրամադրում է մանրամասն անատոմիական և ֆունկցիոնալ տեղեկատվություն՝ պատկերի բարձր որակով և տարածական լուծաչափով: Ախտորոշման արդյունքները բարելավելու համար 2008 թ. Առաջարկվեց [29] օգտագործել հատուկ կոնտրաստանյութ՝ գերպարամագնիսական երկաթի օքսիդ, որը մեծացնում է մետաստազավորված ավշահանգույցներն առողջներից տարբերակելու ունակությունը։ Այս կոնտրաստով ՄՌԼԳ-ն ցույց տվեց ավշանոթների և ավշահանգույցների տեսապատկերման բարձր սպեցիֆիկություն: Մետավերլուծությունը ցույց է տվել, որ ՄՌԼԳ-ի զգայունությունը և սպեցիֆիկությունը, համապատասխանաբար, կազմում են 90% և 96% [30]: Կոնտրաստանյութերի և ՄՌՇ-ի բարելավումները հնարավորություն կտան հետագայում բարելավելու դրա արդյունավետությունը այս ոլորտում: Այնուամենայնիվ, մեթոդը ռադիոակտիվ է և թույլ չի տալիս իրական ժամանակում ԱՀ-ի դիտարկումը: Կոնտրաստով ուժեղացված ՈՒՁՀ (ԿՈւՁՀ, CEUS). սովորական ՈւՁՀ-ն ոչ ինվազիվ է և առաջարկում է հետազոտվող դաշտի բազմաշերտ և բազմանկյուն պատկերներ: Կան զեկույցներ [31] սովորական ՈւՁՀ-ով չարորակ ավշահանգույցների տեսապատկերման մասին, սակայն, ընդհանուր առմամբ, արդյունքները կլինիկորեն այնքան էլ գոհացուցիչ չեն: ԿՈւՁՀ-ն դրսևորում է առավելություններ ախտահարված ավշահանգույցների տեսապատկերման հարցում [32]։ Բայց, ցավոք, ՈւՁՀ-ի համար օգտագործվող կոնտրաստանյութերի անվտանգությունն ապացուցված չէ, և հետագա հետազոտությունների կարիք կա: Մերձինֆրակարմիր սպեկտրոսկոպիա (ՄԻԿՍ, NIR). դեղորայքի հետազոտության զարգացման հաջորդ քայլը ճապոնացի վիրաբույժների կողմից ՄԻԿՍ-ի մշակումն է՝ օգտագործելով ԻՑԿ մարկերը [33-35]: Վերջինս ջրալույծ միացություն է և լայնորեն օգտագործվում է սրտային արտանետման գնահատման, անոթագրության, ակնաբուժության և պլաստիկ վիրաբուժության համար: ԻՑԿ-ն եռկարբոցիանինային ներկ է, որի կլանման և արտացոլման սպեկտրը գտնվում է ինֆրակարմիր տիրույթում. կլանումը 790-805 նմ, արտացոլումը` 825-835 նմ: Ի տարբերություն տեսանելի լույսի, ինֆրակարմիր ճառագայթումը ավելի լավ է թափանցում պիգմենտ պարունակող հյուսվածքների միջով (պիգմենտային էպիթելի մելանինի հատիկներ):
Որպես լուծույթ օգտագործվում է ներարկման ԻՑԿ, որը որպես կայունացուցիչ պարունակում է նաև կալիումի յոդիդի 5% լուծույթ։ Այն յոդի անօրգանական ձևն է, և մինչ օրս օրգանական յոդի նկատմամբ ալերգիկ հիվանդների մոտ ալերգիկ ռեակցիաների դեպքեր չեն արձանագրվել: ԻՑԿ-անոթագրությունը հակացուցված է լյարդի ֆունկցիայի խանգարմամբ, հիպերթիրեոզով, խեցգետնակերպերի և փափկամարմինների նկատմամբ ալերգիա ունեցող հիվանդների մոտ: Ներկանյութը չի անցնում ընկերքի միջով, սակայն հղիության ընթացքում դրա օգտագործման հետ կապված ուսումնասիրություններ չեն իրականացվել [36]:
Երբ ԻՑԿ-ի միկրոչափաբաժինները ներմաշկային եղանակով ներարկվում են լիմֆոդրենաժի հեռավոր հատվածներում (0,025 մգ/0,1 մլ յուրաքանչյուր ներարկման տեղամասի համար): ԻՑԿ-ն կապվում է ալբումինի հետ. այս միացությունը հատուկ ներծծվում է ԱՀ-ի կողմից և ֆլյուորեսցենտային պատկերն արտացոլվում է էկրանին: Ավշագրության այս մեթոդը կարող է ճանաչել ավշանոթները՝ հայտնաբերելով մերձինֆրակարմիր ճառագայթումը մակերևույթից մինչև 10-12 մմ խորության վրա գտնվող հյուսվածքներում [37]:
Ներվիրահատական պայմաններում ներարկվող ԻՑԿ-ն ներծծվում է ԱՀ-ում և իրական ժամանակում հնարավորություն է տալիս վիզուալացնել ոչ միայն ավշահանգույցները, այլև ավշանոթները՝ թույլ տալով հետևել ներարկման տեղամասից աշվի արտահոսքին առանց որևէ կտրվածքի [38]: Ի վերջո, մեթոդը տարբերվում է մի շարք կիրառվողներից ռադիոակտիվ իզոտոպի օգտագործման բացակայությամբ։
Աղյուսակ 1-ից երևում է, որ ԻՑԿ մարկեր կիրառող մեթոդներից ՄԻԿՍ-ի վիզուալացման համակարգն ամենահարմարն է մեր հետաքրքրության ոլորտի համար: Ելնելով դրանից՝ ստորև ներկայացվում է ՄԻԿՍ-ի ավելի մանրակրկիտ վերլուծությունը։
ՄԻԿՍ-Ի ԿԼԻՆԻԿԱԿԱՆ ՕԳՏԱԳՈՐԾՈՒՄԸ ԱՎՇԱՅՏՈՒՑԻ/ԼԻՄՖԵԴԵՄԱՅԻ ԱԽՏՈՐՈՇՄԱՆ ՄԵՋ
ՄԻԿՍ-ի միջոցով լիմֆեդեմայի կլինիկական գնահատումը մակերեսային ֆունկցիոնալ ավշային անոթների և հանգույցների հայտնաբերմամբ ու հետազոտմամբ տեխնիկապես հեշտ է, նվազագույն ինվազիվ և ճշգրիտ: Օգատան և համահեղ. (2007) նշում են ավշանոթների հաջող դիտարկումը երկրորդական լիմֆեդեմայով հիվանդների մոտ՝ օգտագործելով այս մեթոդը ներվիրահատական եղանակով, իրական ժամանակում [39]։ Հոդվածում հեղինակները ցույց են տալիս մեթոդի գերազանցությունը ԼՍԳ-ի նկատմամբ, և 112 հիվանդների համեմատական ուսումնասիրության համաձայն՝ պարզում, որ մեթոդն ավելի զգայուն է վերին վերջույթի երկրորդական լիմֆեդեմայի ախտորոշման հարցում [39]։ Մեթոդի օգնությամբ հաջողությամբ մշակվել և ներդրվել է լիմֆեդեմայի դասակարգման համակարգը [4041], որտեղ հեղինակները, ուսումնասիրելով 72 հիվանդի ստորին վերջույթները, արդյունքում առաջարկել են վերջույթների վիճակի 12 աստիճան՝ հաշվի առնելով լիմֆոդրենաժի բնութագրերը։
Լիմֆեդեման կարող է լինել ինչպես վիրահատության, այնպես էլ ճառագայթային թերապիայի բարդություն, և կարող է հատկապես թուլացնել այն տարածքներում, որտեղ բուժման տարբերակները սահմանափակ են: Թեև վերին և ստորին վերջույթների լիմֆեդեման կարող է արդյունավետ բուժվել մեխանիկական լիմֆոդրենաժով, գլխի և պարանոցի շրջանի լիմֆեդեմայի դեպքում պրոքսիմալ ավշահոսքի ուղղակի սեղմումը դժվար է:
ՄԻԿՍ մեթոդը, ապահովելով ֆունկցիոնալ ավշանոթների տեսապատկերում, հնարավորություն է տալիս իրականացնել արդյունավետ մեխանիկական լիմֆոդրենաժ: Իրենց հրապարակման մեջ Յ.Ռ. Վան դեր Վորստը և համահեղ. (2011) հաղորդում են մեթոդի գերազանցության մասին՝ գոյություն ունեցողների նկատմամբ, և նշում ԱՀ-ի մասին ավելի ճշգրիտ և մանրամասն տեղեկություններ ստանալու հնարավորությունը [42]:
Տ. Յամամոտոն և համահեղ. (2011) իրականացրել են ԱՀ-ի ուսումնասիրություն՝ օգտագործելով ՄԻԿՍ մեթոդը ԻՑԿ մարկերով [43]: Հետազոտությանը մասնակցել են հիվանդներ, որոնք քաղցկեղի բուժում են անցել գինեկոլոգիական և ուրոլոգիական բաժանմունքներում՝ առանց ստորին վերջույթների լիմֆեդեմայի ախտանիշների: ՄԻԿՍ-ով անախտանշան վերջույթները հետազոտելիս մաշկի մեջ հայտնաբերվել է ավշի հետհոսք: Հեղինակները եզրակացրել են, որ սա գաղտնի փուլում լիմֆեդեմայի վաղ նշան է. 28 հիվանդի մոտ հետազոտված 56 վերջույթներից 19-ի մոտ նկատվել են գաղտնի անախտանշան լիմֆեդեմայի նշաններ:
Կարելի է եզրակացնել, որ վաղ լիմֆեդեմայի ախտորոշման ՄԻԿՍ մեթոդը համապարփակ է և չունի նմանակներ: Հ. Սաումին և համահեղ. (2012) նշում են, որ ՄԻԿՍ-ն օգտակար է լիմֆեդեմատոզ թևի գործող ավշանոթները գտնելու համար, որոնցում նորմալ ավշային կառույցները կարող են էականորեն փոփոխված լինել և նաև ընդգծում են, որ մեթոդի կիրառումը կարող է բարելավել ավիշ-երակային շունտավորման արդյունքները [44]:
ՄԻԿՍ-Ի ԿԻՐԱՌՈՒՄԸ ՉԱՐՈՐԱԿ ՆՈՐԱԳՈՅԱՑՈՒԹՅՈՒՆՆԵՐԻ ԱԽՏՈՐՈՇՄԱՆ ԵՎ ԲՈՒԺՄԱՆ ՄԵՋ
Քաղցկեղով հիվանդների մոտ դիսեկցիա հաճախ կատարվում է ՊԱՀ-ի տեղորոշման և բիոպսիայի համար, նույնիսկ կլինիկական և ճառագայթային N0 փուլով հիվանդների մոտ: Այս հիվանդների ≈25%-ի մոտ հայտնաբերվում են ավշահանգույցների մետաստազներ [45]: Գործընթացը հիմնված է այն տեսության վրա, որ ուռուցքից հոսքը հաջորդաբար անցնում է ավշահանգույցների առաջին մակարդակ (այսինքն՝ ՊԱՀ), այնուհետև դեպի մնացած ավշահանգույցների ավազան:
Կրծքագեղձի քաղցկեղի դեպքում ռադիոկոլոիդների օգտագործումը կարելի է համարել ՊԱՀ-երի հայտնաբերման ոսկե ստանդարտ: Այնուամենայնիվ, ռադիոկոլոիդների թերությունները իրական ժամանակի պատկերների բացակայությունն են և միջուկային բժշկության լրացուցիչ անձնակազմի անհրաժեշտությունը:
Կան հրապարակումներ կեղծ բացասական ազդանշանային հանգույցների առկայության մասին։ Հիմնվելով գրականության տվյալների վրա՝ Յ.Ռ. Վան դեր Վորստը և համահեղ. (2013) պնդում են, որ 3 հիվանդից 1-ի մոտ ուռուցքային բջիջները հայտնաբերվում են ոչ ՊԱՀ-ում, մինչդեռ ՊԱՀ-ի բիոպսիան բացասական է լինում: Այս կեղծ բացասական ազդանշանային հանգույցների պատճառը մնում է անհասկանալի: Հնարավոր բացատրությունն այն է, որ կան լիմֆոդրենաժի մի քանի մոդելներ, և մեզ հայտնի ՊԱՀ-ը կարող է կեղծ բացասական պատասխան տալ: ՊԱՀ-ի բացասական բիոպսիայից հետո մելանոմայի ռեցիդիվով հիվանդները ավելի կարճ ապրելիություն են ունենում՝ համեմատած ՊԱՀ-ի դրական բիոպսիայով հիվանդների հետ [46]: Ըստ գրականության տվյալների, կեղծ բացասական պատասխանի հնարավոր պատճառները կարող են լինել անբավարար ռադիոգրաֆիկ տվյալները, ուսումնասիրված հանգույցի սխալ հյուսվածաբանական գնահատումը և վիրաբույժի սխալը ՊԱՀ-երի նույնականացման հարցում [47,48]: Հետազոտությունը ցույց է տվել, որ վերին վերջույթի մելանոմայով հիվանդների 28%-ն ունեցել է ՊԱՀ-երի մի քանի լողավազան [49]: Յ. Մատսոնը և համահեղ. (2008) հրապարակել են գլխի և պարանոցի մելանոմայի դեմ դեղամիջոցների ուսումնասիրություն, որտեղ նրանք պնդում են, որ ՊԱՀ-ի մի քանի լողավազաններ կան, ինչը մեծացնում է բիոպսիայի դեպքում կեղծ բացասական պատասխանի վտանգը [50]:
ԻՑԿ-ով ՄԻԿՍ-ը հաջողությամբ օգտագործվել է կրծքագեղձի քաղցկեղով, մելանոմայով, արգանդի վզիկի քաղցկեղով և այլ չարորակ նորագոյացություններով հիվանդների մոտ ՊԱՀ-եր հայտնաբերելու համար [42,51-53]: Տեսապատկերման այս մեթոդը խոստումնալից է ՊԱՀ-ի ներվիրահատական ավելի ճշգրիտ նույնականացման համար: Այն որոշիչ դեր ունի մետաստազների ախտորոշման գործում և լայնորեն կիրառվում է այնպիսի չարորակ նորագոյացությունների ախտորոշման մեջ, ինչպիսիք են կրծքագեղձի քաղցկեղը [54], մելանոման [55] և ստամոքսի քաղցկեղը [56]:
Իհարկե, ԱՀ-ի տեսապատկերման գործընթացում ընտրության մեթոդը մնում է ԼՍԳ-ն, սակայն որոշ ուսումնասիրություններում դրա զգայունությունը ցածր է՝ պայմանավորված լիմֆոդրենաժի ընդհանուր ընդունված ուղիներից շեղվելու առկայությամբ [57]: Ճշգրիտ անատոմիական դիրքավորումը կարելի է ձեռք բերել ՄԻԿՍ մեթոդի միջոցով. այս պարզ և ճշգրիտ մեթոդը վերջերս ավելի ու ավելի է կիրառվում գործնականում: Դ. Մուրավան և համահեղ. (2009) ցույց են տվել մեթոդի գերազանցությունը կրծքագեղձի քաղցկեղի դեպքում ռադիոկոլոիդայինի համեմատ [58]: Ք. Հիրխեն և համահեղ. (2010) ցույց են տվել, որ այս մեթոդով ՊԱՀ-ի հայտնաբերումն ուղիղ աղիքի քաղցկեղի դեպքում ունի զգալիորեն ավելի բարձր հայտնաբերման մակարդակ (83%), քան ռադիոնուկլիդներ օգտագործող մեթոդները (75%) [59]: Կան նաև տվյալներ կրծքագեղձի (97,7%) և հաստ աղիքի քաղցկեղի (96%) դեպքում ՊԱՀ-ի հայտնաբերման բարձր մակարդակի մասին [60,61]: Այսպիսով, աճող թվով ուսումնասիրություններ ցույց են տալիս, որ ԻՑԿ մարկերով ՄԻԿՍ-ն ընտրության օպտիմալ մեթոդ է ՊԱՀ-ի նույնականացման համար:
Մ.Բ. Օլդրիչն ու համահեղ. (2012) ցույց են տվել, որ ԻԿՑ-ի տարբեր կոնցենտրացիաների օգտագործումը ինֆրակարմիր ճառագայթման հետ միասին էական ազդեցություն չի ունենում անոթային կծկման հաճախականության և լիմֆոդրենաժի շարժման արագության վրա [62]:
Ն. Ունոն և համահեղ. (2010) հրապարակել են մարդկանց ԱՀ-ի կծկման ֆունկցիայի ուսումնասիրություն՝ օգտագործելով ԻՑԿ մարկերով ֆլյուորեսցենտային տեսապատկերում: Հեղինակները պնդում են, որ մեթոդն անվտանգ է, տեխնիկապես հեշտ իրականացվող և խնայող՝ լիմֆոդրենաժի ֆունկցիոնալ բնութագրերը չափելու համար [63]:
Աշխարհահռչակ մի շարք պլաստիկ վիրաբույժներ իրենց աշխատանքում բազմիցս շեշտում են ԱՀ-ի կարևոր դերը նորմալ և ախտաբանական պայմաններում, ինչպես նաև նշում են, որ լիմֆոդրենաժի վնասման կանխարգելումը կարևոր տարր է հետվիրահատական բարդությունների կանխարգելման գործում:
Առաջարկվել է ՄԻԿՍ մեթոդը ԻՑԿ մարկերով: Այս համեմատաբար անվտանգ և տեխնի-
կապես հեշտ կատարվող մեթոդը վիրահատարանում թույլ է տալիս իրական ժամանակում տեսապատկերել ԱՀ-ի դինամիկ կարգավիճակը և բացահայտել դրա կառուցվածքային միավորներն ու կանխել դրանց հետագա վնասումը: Սույն հոդվածում բերվեցին ԱՀ-ի տեսապատկերման մեթոդների կիրառման օրինակներ՝ լիմֆոդրենաժի դինամիկ կարգավիճակը ուսումնասիրելու և ՊԱՀ-երի տեղակայումը որոշելու համար: Նկարագրված են ինչպես համաշխարհային պրակտիկայում, այնպես էլ Հայաստանում օգտագործվող կոնտրաստանյութեր:
Հաշվի առնելով ԻՑԿ-ով ՄԻԿՍ մեթոդի հարաբերական նոր լինելը՝ դրա հնարավորություններն ու սահմանափակումներն ավելի մանրամասն ուսումնասիրելու և վերլուծելու համար անհրաժեշտ են հետագա հետազոտություններ կլինիկական և փորձարարական պայմաններում։
ԳՐԱԿԱՆՈՒԹՅԱՆ ՑԱՆԿ
- Выренков ЮЕ, Москаленко ВИ, Москаленко ВВ и др. Роль лимфатической системы в патогенезе воспалительных процессов. методы лимфатической терапии. Вестник Лимфологии. 2014;2:4-10
- Сапин МР. Лимфатическая система и ее роль в иммунных процессах. Морфология. 2007;131:18-22
- Pessa JE. SMAS fusion zones determine the subfascial and subcutaneous anatomy of the huma face: fascial spaces, fat compartments, and models of facial aging. Aesthet Surg J. 2016;36:515-26
- Mottura АА. Face lift postoperative recovery. Aesthetic Plast Surg. 2002;26:172-80
- Mendelson BC. Facelift anatomy, SMAS, retaining ligaments and facial spaces. In: Aston J, Steinbrech DS, Walden JL, eds. Aesthetic Plastic Surgery. London: Saunders Elsevier; 2009:53-72
- Адамян РТ, Миланов НО, Юршевич ЭН и др. Устранение рубцовых деформации лица с применением пластики местными тканями на основе представлений о кровоснабжении и лимфоотоке. Клиническое наблюдение. Анналы Пластической, Реконструктивной и Эстетической Хирургии. 2008;2:39-46
- Meade RA, Teotia SS, Griffeth LK, Barton FE. Facelift and patterns of lymphatic drainage. Aesthet Surg J. 2012:32:39-45
- Pan WR, Suami H, Corlett RJ, Ashton MW. Lymphatic drainage of the nasal fossae and nasopharynx: preliminary anatomical and radiological study with clinical implications. Head Neck. 2009;31:52-57
- Aselli G. De lactibus sive lacteis venis. Milan, Italy: J. B. Bidellius; 1627
- Nuck A. Adenographia curiosa et uteri foeminei anatome nova. Lugduni Batavorum: P. vander Aa; 1692
- Sappey PC. Anatomie, physiologie, pathologie des vaisseaux lymphatiques consideres chez l’homme et les vertebres. Paris: Adrien Delahaye; 1874
- Kinmonth JB. Lymphangiography in man; a method of outlining lymphatic trunks at operation. Clin Sci (Lond). 1952;11:13-20
- Carlson GW, Murray DR, Lyles RH et al. Sentinel lymph node biopsy in the management of cutaneous head and neck melanoma. Plast Reconstr Surg. 2005;115:721-8
- Soto-Miranda MA, Suami H, Chang DW. Mapping superficial lymphatic territories in the rabbit. Anat Rec (Hoboken). 2013;296(6):965-970
- Alitalo A, Detmar M. Interaction of tumor cells and lymphatic vessels in cancer progression. Oncogene 2012;31:4499-508
- Castenholz A. Structure of initial and collecting lymphatic vessels. In: Olszewski WL, editor. Lymph stasis: Pathophysiology, diagnosis and treatment. Boca Raton: CRC Press; 1991:15-42
- Xiong L, Engel H, Gazyakan E et al. Current techniques for lymphatic imaging: State of the art and future perspectives. Eur J Surg Oncol. 2014;40:270-6
- Kerchner K, Fleischer A, Yosipovitch G. Lower extremity lymphedema update: pathophysiology, diagnosis, and treatment guidelines. J Am Acad Dermatol. 2008;59:324-31
- Летягин АЮ, Тулупов АА, Савелов АА и др. Использование МР-томографии для оценки лимфатической системы. Вестник НГУ. 2005;3:71-83
- Li JH, He NS. Prevention of iodinated contrast-induced nephropathy. Chin Med J (Engl). 2011;124:4079-82.
- Nawaz K, Hamad MM, Sadek S et al. Dynamic lymph flow imaging in lymphedema. Normal and abnormal patterns. Clin Nucl Med. 1986;11:653-8
- Szuba A, Strauss W, Sirsikar SP, Rockson SG. Quantitative radionuclide lymphoscintigraphy predicts outcome of manual lymphatic therapy in breast cancer-related lymphedema of the upper extremity. Nucl Med Commun. 2002;23:1171-5
- Petersson J, Sánchez-Crespo A, Larsson SA, Mure M. Physiological imaging of the lung: single-photon-emission computed tomography (SPECT). J Appl Physiol (1985). 2007;102:468-76
- Roarke MC, Nguyen BD, Pockaj BA. Applications of SPECT/CT in nuclear radiology. AJR Am J Roentgenol. 2008; 191:W135-50
- Sung YM, Lee KS, Kim B-T et al. Lobar mucinous bronchioloalveolar carcinoma of the lung showing negative FDG uptake on integrated PET/CT. Eur Radiol. 2005;15:2075-8
- Tong S, Alessio AM, Kinahan PE. Image reconstruction for PET/CT scanners: past achievements and future challenges. Imaging Med. 2010;2:529-45
- Hicks RJ, Ware RE, Lau EWF. PET/CT: will it change the way that we use CT in cancer imaging? Cancer Imaging. 2006;6:S52-62
- Bisdas S, Nägele T, Schlemmer HP et al. Switching on the lights for real-time multimodality tumor neuroimaging: The integrated positron-emission tomography/MR imaging system. AJNR Am J Neuroradiol. 2010;31(4):610-4
- Azoulay R, Olivier P, Baud O et al. USPIO (Ferumoxtran-10)enhanced MRI to visualize reticuloendothelial system cells in neonatal rats: feasibility and biodistribution study. J Magn Reson Imaging. 2008;28:1046-52
- Wu L, Cao Y, Liao C, Huang J, Gao F. Diagnostic performance of USPIO-enhanced MRI for lymph-node metastases in different body regions: a meta-analysis. Eur J Radiol. 2011;80(2):582-9
- Tregnaghi A, De Candia A, Calderone M et al. Ultrasonographic evaluation of superficial lymph node metastases in melanoma. Eur J Radiol. 1997;24:216-21
- Laghi F, Catalano O, Maresca M et al. Indeterminate, subcentimetric focal liver lesions in cancer patients: additional role of contrastenhanced ultrasound. Ultraschall Med. 2010;31:283-8
- Kitai T, Inomoto T, Miwa M, Shikayama T. Fluorescence navigation with indocyanine green for detecting sentinel lymph nodes in breast cancer. Breast Cancer. 2005;12:211-5
- Unno N, Inuzuka K, Suzuki M et al. Preliminary experience with a novel fluorescence lymphography using indocyanine green in patients with secondary lymphedema. J Vasc Surg. 2007;45:1016-21
- Koshima I. Intraoperative lymphography using indocyanine green dye for near-infrared fluorescence labeling in lymphedema. Ann Plast Surg.2007;59:180-4
- Дитмар С, Хольц ФГ. Флюоресцентная ангиография в офтальмологии атлас. ГЭОТАР-Медиа; 2011:224 с
- Suami H, Chang DW, Yamada K, Kimata Y. Use of indocyanine green fluorescent lymphography for evaluating dynamic lymphatic status. Plast Reconstr Surg. 2011;127:74e-76e
- Maus EA, Tan IC, Rasmussen JC et al. Near-infrared fluorescence imaging of lymphatics in head and neck lymphedema. Head Neck. 2012;34:448-53
- Ogata F, Narushima M, Mihara M et al. Intraoperative lymphography using indocyanine green dye for near-infrared fluorescence labeling in lymphedema. Ann Plast Surg. 2007;59:180-4
- Mihara M, Hara H, Araki J et al. Indocyanine green (ICG) lymphography is superior to lymphoscintigraphy for diagnostic imaging of early lymphedema of the upper limbs. PloS One. 2012;7:e38182
- Mihara M, Hayashi Y, Hara H et al. High-accuracy diagnosis and regional classification of lymphedema using indocyanine green fluorescent lymphography after gynecologic cancer treatment. Ann Plast Surg. 2014;72:204-8
- van der Vorst JR, Hutteman M, Gaarenstroom KN et al. Optimization of near-infrared fluorescent sentinel lymph node mapping in cervical cancer patients. Int J Gynecol Cancer. 2011;21:1472-8
- Yamamoto T, Matsuda N, Doi K et al. The earliest finding of indocyanine green lymphography in asymptomatic limbs of lower extremity lymphedema patients secondary to cancer treatment: the modified dermal backflow stage and concept of subclinical lymphedema. Plast Reconstr Surg. 2011;128:314e-321e
- Suami H, Chang D, Skoracki R et al. Using indocyanine green fluorescent lymphography to demonstrate lymphatic architecture. J Lymphoedema. 2012;7:25-9
- Sheahan P, O’Keane C, Sheahan JN, O’Dwyer TP. Effect of tumour thickness and other factors on the risk of regional disease and treatment of the N0 neck in early oral squamous carcinoma. Clin Otolaryngol Allied Sci. 2003;28:461-71
- van der Vorst JR, Schaafsma BE, Verbeek FP et al. Near-infrared fluorescence sentinel lymph node mapping of the oral cavity in head and neck cancer patients. Oral Oncol. 2013;49:15-9
- Miller MW, Vetto JT, Monroe MM et al. False-negative sentinel lymph node biopsy in head and neck melanoma. Otolaryngol Head Neck Surg. 2011;145:606-11
- Sondak VK, Zager JS. Who is to blame for false-negative sentinel node biopsies in melanoma? Ann Surg Oncol. 2010;17:670-3
- Vidal-Sicart S, Pons F, Piulachs J et al. Mid-arm sentinel lymph nodes showing surprising drainage from a malignant melanoma in the forearm. Clin Nucl Med. 1998;23:273-74
- Mattsson J, Bergkvist L, Abdiu A et al. Sentinel node biopsy in malignant melanoma: Swedish experiences 1997– 2005. Acta Oncol. 2008 ;47 :1519-25
- Hutteman M, Mieog JS, van der Vorst JR et al. Randomized, double-blind comparison of indocyanine green with or without albumin premixing for near-infrared fluorescence imaging of sentinel lymph nodes in breast cancer patients. Breast Cancer Res Treat. 2011;127:163-70
- Hutteman M, van der Vorst JR, Gaarenstroom KN et al. Optimization of near-infrared fluorescent sentinel lymph node mapping for vulvar cancer. Am J Obstet Gynecol. 2012;206:89.e1-89.e895
- Mieog JS, Troyan SL, Hutteman M et al. Toward optimization of imaging system and lymphatic tracer for near-infrared fluorescent sentinel lymph node mapping in breast cancer. Ann Surg Oncol. 2011;18:2483-91
- Aguiar PH, Pinheiro LG, Mota RM et al. Sentinel lymph node biopsy in patients with locally advanced breast cancer after neoadjuvant chemotherapy. Acta Cir Bras. 2012;27:912-6
- Samra S, Sawh-Martinez R, Tom L et al. A targeted approach to sentinel lymph node biopsies in the parotid region for head and neck melanomas. Ann Plast Surg. 2012;69:415-7
- Gretschel S, Bembenek A, Hünerbein M et al. Efficacy of different technical procedures for sentinel lymph node biopsy in gastric cancer staging. Ann Surg Oncol. 2007;14:2028-35
- Vidal M, Vidal-Sicart S, Torrents A et al. Accuracy and reproducibility of lymphoscintigraphy for sentinel node detection in patients with cutaneous melanoma. J Nucl Med. 2012;53:1193-9
- Murawa D, Hirche C, Dresel S et al. Sentinel lymph node biopsy in breast cancer guided by indocyanine green fluorescence. Br J Surg. 2009;96:1289-94
- Hirche C, Dresel S, Krempien R et al. Sentinel node biopsy by indocyanine green retention fluorescence detection for inguinal lymph node staging of anal cancer: preliminary experience. Ann Surg Oncol. 2010a;17:2357-62
- Hirche C, Murawa D, Mohr Z et al. ICG fluorescence-guide sentinel node biopsy for axillary nodal staging in breast cancer. Breast Cancer Res Treat 2010b;121:373-8
- Hirche C, Mohr Z, Kneif S et al. Ultrastaging of colon cancer by sentinel node biopsy using fluorescence navigation with indocyanine green. Int J Colorect Dis. 2012;27:319-24
- Aldrich MB, Davies-Venn C, Angermiller B et al. Concentration of indocyanine green does not significantly influence lymphatic function as assessed by near-infrared imaging. Lymphat Res Biol. 2012;10:20-24
- Unno N, Nishiyama M, Suzuki M et al. A novel method of measuring human lymphatic pumping using indocyanine green fluorescence lymphography. J Vasc Surg. 2010;52:946-52