Эмбриологические особенности программ экстракорпорального оплодотворения у пациентов с бесплодием неясного генеза
Евгения Киракосян
Первый Московский государственный медицинский университет имени И.М. Сеченова
Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова
Абстракт
Проведено обсервационное, аналитическое, когортное, ретроспективно-проспективное исследование по изучению клинических характеристик и эмбриологических показателей программ экстракорпорального оплодотворения у женщин с бесплодием неясного генеза (93 женщины, 108 программ экстракорпорального оплодотворения) в сравнении с пациентками, имеющими трубно-перитонеальный фактор бесплодия (45 пациенток, 49 программ экстракорпорального оплодотворения). Описан “клинический портрет” женщины с бесплодием неясного генеза и выделены его особенности при сравнении с пациентками, имеющими трубно-перитонеальный фактор бесплодия. В качестве конечной точки рассматривалась частота бластуляции в программах экстракорпорального оплодотворения, которая оказалась статистически значимо ниже в группе бесплодия неясного генеза, что является признаком нарушения раннего эмбриогенеза и, следовательно, показанием для более раннего проведения экстракорпорального оплодотворения с целью достижения беременности. При этом супружеским парам с бесплодием неясного генеза нецелесообразно проводить расширенное диагностическое обследование, эмпирическое лечение, оплодотворение методом инъекции сперматозоида в цитоплазму ооцита, преимплантационное генетическое тестирование на анеуплоидии. Также представлены результаты пилотного исследования – полноэкзомного секвенирования наиболее типичных супружеских пар с бесплодием неясного генеза.
Ключевые слова: бесплодие неясного генеза, необъяснимое бесплодие, идиопатическое бесплодие, арест раннего эмбриогенеза, экстракорпоральное оплодотворение, полноэкзомное секвенирование
DOI 10.54235/27382737-2024.v4.2-82
Введение
Бесплодие неясного генеза (БНГ) устанавливается у пар, при стандартном обследовании которых причина бесплодия не выявляется: менструальный цикл регулярный, овуляторный, маточные трубы проходимы, эндометрий без патологических изменений, показатели спермы в норме, при проведении лапароскопии и гистероскопии патология не обнаруживается – все это позволяет отнести БНГ к так называемым диагнозам исключения [1-3]. Необъяснимое бесплодие, идиопатическое бесплодие – синонимы БНГ [4-6].
По данным зарубежной и отечественной литературы, проводимые в мире исследования, посвященные изучению БНГ, немногочисленны и обладают невысоким уровнем доказательности. Международным консенсусом были определены 10 приоритетных направлений будущих исследований в отношении бесплодия, в их числе – БНГ [7]. Всеобщий интерес специалистов к проблеме БНГ объясняется отсутствием у этого понятия точного определения, отражающего его этиологию и патогенез, и, соответственно, достоверной информации о тактике ведения пациентов с БНГ, что составляет клиническую часть проблемы. В то же время БНГ представляет собой научный интерес как наиболее наглядная клиническая модель нарушений репродуктивной системы, при которой репродуктивная система анатомически и функционально полноценна, однако беременность не наступает, что позволяет исследовать БНГ для выявления признаков и причин неочевидных нарушений репродуктивной функции, в первую очередь, с клинической, эмбриологической и генетической точек зрения.
Целью данного исследования было оптимизировать тактику ведения пациентов с БНГ на основе анализа анамнеза, клинических, лабораторных, инструментальных показателей и результатов программ вспомогательных репродуктивных технологий.
Методы
Исследование проводилось в 2021-2022 году на базе кафедры акушерства, гинекологии, перинатологии и репродуктологии Первого Московского государственного медицинского университета имени И.М. Сеченова в Национальном медицинском исследовательском центре акушерства, гинекологии и перинатологии имени академика В.И. Кулакова: клиническая часть и эмбриологическая часть работы проводились в научно-клиническом отделении вспомогательных репродуктивных технологий им. Ф. Паулсена Института репродуктивной медицины, генетическая часть исследования заключалась в проведении преимплантационного генетического тестирования на анеуплоидии (ПГТ-А) эмбрионов исследуемых групп и полноэкзомного секвенирования супружеских пар с БНГ в отделении клинической генетики Института репродуктивной генетики.
Ретроспективно и проспективно были проанализированы клинические характеристики 1191 супружеской пары с бесплодием, из которых в группу исследования были включены 93 женщины из супружеских пар с БНГ, в группу сравнения – 45 женщин с трубно-перитонеальным фактором бесплодия (ТПБ). Был проведен сравнительный анализ эмбриологических показателей программ экстракорпорального оплодотворения (ЭКО): 108 программ у женщин с БНГ и 49 программ у женщин с ТПБ. Сравниваемые группы пациентов были сопоставимы по протоколам овариальной стимуляции, дозам гонадотропинов, количеству дней стимуляции. Мужчины из супружеских пар групп БНГ и ТПБ имели нормозооспермию.
БНГ, как диагноз исключения, устанавливался при: регулярном менструальном цикле продолжительностью от 23 до 35 дней, подтвержденном наличии овуляции (по данным теста на овуляцию, лабораторного анализа на уровень прогестерона в крови в лютеиновой фазе менструального цикла, ультразвукового исследования и лапароскопии в лютеиновой фазе менструального цикла при визуализации желтого тела; неизмененных полости матки и маточных трубах по данным гистеросальпингографии и лапароскопии; соответствии показателей спермограммы эталонным значениям ВОЗ (2010 г.) [8].
В группу ТПБ включались женщины, у которых маточные трубы отсутствовали или были непроходимы с обеих сторон по данным гистеросальпингографии и лапароскопии.
Критерии включения: возраст до 35 лет на момент установления диагноза бесплодия; продолжительность бесплодия не менее 3 лет; отсутствие очевидных причин бесплодия, хромосомной патологии, всех известных наследственных синдромов, врожденных аномалий, в том числе матки, преждевременной недостаточности яичников, эндокринно-метаболического синдрома, синдрома поликистозных яичников, ановуляции, гипогонадотропного гипогонадизма, всех онкологических заболеваний, в том числе в анамнезе, атипичной гиперплазии эндометрия, эндометриоза, миомы матки, хронического эндометрита, вируса иммунодефицита человека, вирусных гепатитов; нормозооспермия у партнера; нормальный женский – (46, ХХ) и мужской – (46, ХУ) кариотип.
В качестве первичной конечной точки рассматривалась частота бластуляции в программах ЭКО.
Обследование пациентов включало сбор анамнеза (анкетирование), общеклиническое исследование, исследование на инфекции, гормональное исследование и определение уровней аутоантител к ткани щитовидной железы, оценку овариального резерва, оценку результатов расширенной спермограммы, ПГТ-А, полноэкзомное секвенирование, ультразвуковое исследование органов и систем, гистеросальпингографию, гистероскопию, лапароскопию, аспирационную биопсию эндометрия, морфологическую оценку состояния эндометрия, ЭКО с оценкой эмбриологических показателей.
Результаты и обсуждение
Частота выявления БНГ составила 6,07-11,25%.
На первом этапе исследования был проведен анализ анамнестических, клинических, лабораторных и инструментальных характеристик пациентов с БНГ и ТПБ.
В группе ТПБ отмечалось статистически значимо (p<0,05) больше женщин, которым проводились лапароскопия (94%), гистероскопия (88%), биопсия эндометрия (83%), по результатам которых имелись сопутствующие изменения (50%), другие вмешательства (82%), в том числе лапаротомия (64%), операции по восстановлению проходимости маточных труб (33%) в анамнезе, чем в группе БНГ (47%, 58%, 56%, 27%, 24%, 2% и 7% соответственно), что характерно для патогенеза формирования ТПБ.
Были установлены различия между группами БНГ и ТПБ по количеству беременностей, окончившихся родами, в анамнезе – 11% и 21% соответственно; беременностей с неблагоприятным исходом в анамнезе – 44% и 54% соответственно: неразвивающаяся беременность (14% и 17%), самопроизвольный выкидыш (11% и 2%), аборт (7% и 5%), внематочная беременность (2% и 28%), биохимическая беременность (2% и 2%).
В группе БНГ была статистически значимо (p<0,001) больше средняя длительность бесплодия – 5,7 лет, чем в группе ТБП – 4,8 лет, при этом в группе БНГ отмечалось статистически значимо (p<0,05) больше женщин с длительностью бесплодия 6 лет и более – 43%, чем в группе ТПБ – 29%.
В группе ТПБ было статистически значимо (p<0,05) больше женщин с установленным ранее диагнозом – 100%, чем в группе БНГ – 69%. В группе ТПБ было статистически значимо (p<0,05) больше женщин, которые для достижения беременности использовали методы вспомогательной репродукции в анамнезе – 89%, чем в группе БНГ – 67%. В группе БНГ у 27% пациентов была внутриматочная инсеминация (ВМИ) в анамнезе: у 25% беременность не наступила, у 2% случился выкидыш, при этом длительность до обращения в клинику ЭКО в этой подгруппе составила в среднем 6,3 лет. В группе ТПБ отмечалось статистически значимо (p<0,05) больше женщин с безрезультатными попытками ЭКО в анамнезе – 54%, чем в группе БНГ – 38%. Между группами БНГ и ТПБ не было установлено статистически значимых различий в исходах программ ЭКО на перенос эмбриона в анамнезе: частота биохимической беременности – 4,4% и 8,0%, самопроизвольного выкидыша – 2,2% и 5,4%, неразвивающейся беременности – 7,0% и 5,4%, родов – 4,4% и 5,4% соответственно.
Среднее количество программ ЭКО на женщину было одинаковым в группах БНГ и ТПБ (1,4 и 1,4 соответственно). При этом в группе ТПБ отмечалось статистически значимо (p<0,05) больше женщин с одной попыткой ЭКО в анамнезе (39%), в группе БНГ – с двумя попытками ЭКО в анамнезе (36%), для трех и более попыток ЭКО в анамнезе различий между группами не было установлено.
На основе современных методов статистического анализа был описан «клинический портрет» пациентки с БНГ [11]: женщина 33 лет (партнеру 34 года), массой тела 62,6 кг, ростом 165,0 см, с нормальным ИМТ – 22,9 кг/см2, возрастом менархе 13,3 лет, продолжительностью цикла 28,0 дней, длительностью менструального кровотечения 4,7 дня, умеренной болезненностью менструаций – 5,2 баллов, длительностью бесплодия 5,7 лет, с заболеваниями щитовидной железы или пищеварительной системы в трети случаев, без инфекционных и неинфекционных гинекологических заболеваний и хирургических вмешательств на органах малого таза, с родами в анамнезе в десятой части случаев, с неблагоприятным исходом беременностей в анамнезе в половине случаев, с установленным ранее диагнозом и двумя попытками ЭКО в анамнезе в двух третях случаев, ВМИ в анамнезе в трети случаев, с частотой родов в результате ЭКО 4,4-7,4%, с нормальным овариальным резервом по данным АМГ – 2,4 нг/мл и КАФ – 8-12 в фолликулярную фазу.
Мужчины из супружеских пар с БНГ и ТПБ имели нормозооспермию на момент включения в исследование. Выявленные отклонения были транзиторными, и не было объективных оснований рассматривать их как мужской фактор бесплодия. В настоящем исследовании не было ограничения по возрасту мужчин из супружеских пар с БНГ. Тем не менее, проведенный анализ показал отсутствие статистически значимых различий в возрасте мужчин между группами БНГ и ТПБ (≤40 лет – 91% и 88%; >40 лет – 9% и 12% соответственно), что свидетельствует о сопоставимости групп по данному параметру и повышает объективность оценки и интерпретации ключевых показателей исследования.
Несмотря на совершенствование диагностических методов, у большого количества пар, страдающих бесплодием, причина не устанавливается после проведения расширенного обследования. Анализ результатов дополнительных исследований, представленных пациентами при первом обращении, не показал взаимосвязи между БНГ и антигенами HLA II класса, наследственными тромбофилиями, полиморфизмами генов системы гемостаза, аутоантителами, группой крови женщины, поэтому назначение соответствующих исследований пациентам с БНГ нецелесообразно.
Таким образом, пациентки с БНГ были вполне благополучны по клинико-анамнестическим характеристикам и показателям репродуктивной системы, поэтому ответа на вопрос, почему беременность не наступает, на первом этапе работы получено не было.
Вопрос о выжидательной тактике и других методах лечения, прежде всего ВМИ, при БНГ является дискуссионным [12,13]. В настоящей работе был предусмотрен период выжидательной тактики за счет того, что пациенты с БНГ включались в исследование при продолжительности бесплодия не менее 3 лет, что повысило объективность исследования и достоверность полученных данных.
В исследовании 51% женщин из группы БНГ проходили консервативное лечение, то есть в течение последнего года принимали биологически активные вещества (47,8%), гестагены (30,4%), их сочетание (17,4%) или комбинированные оральные контрацептивы (4,3%), и это ни в одном случае не привело к наступлению беременности.
ВМИ проводилась у 27% пациентов с БНГ и имела низкую эффективность: было достигнуто 2% беременностей, все оказались неразвивающимися.
Группы БНГ и ТПБ были сопоставимы по характеристикам программ ЭКО до эмбриологического этапа: протоколам овариальной стимуляции, дозам гонадотропинов (в среднем 225 МЕ/день), количеству дней стимуляции (в среднем 11 дней), количеству преовулятрных фолликулов (в среднем 12,3 и 11,1 соответственно), количеству аспирированных ооцитов (10,8 и 9,0 соответственно).
На втором этапе работы с целью дальнейшего научного поиска причины бесплодия у пациентов с БНГ был проанализирован эмбриологический этап программ ЭКО. Полученные данные свидетельствуют о том, что при БНГ количество зрелых ооцитов достаточное, частота оплодотворения нормальная, однако частота бластуляции низкая, что является признаком нарушения раннего эмбриогенеза и, следовательно, показанием для более раннего использования ЭКО с целью достижения беременности (Таблица 1).
В проведенном исследовании в группе БНГ в 80,3% случаев оплодотворение проводилось методом инъекции сперматозоида в цитоплазму ооцита (ИКСИ), что в значительной степени отражает общепринятую клиническую практику, однако при сравнении ЭКО и ИКСИ частота оплодотворения была одинаковой (Таблица 1).
Снижение частоты бластуляции в группе БНГ происходило за счет остановок развития эмбрионов до 3 суток культивирования включительно, которые происходили в 13,8% (ТПБ – 9,0%).
Частота остановок развития эмбрионов от 3 до 5 суток культивирования не различалась между группами БНГ (44,7%) и ТПБ (44,3%), что подтверждает снижение частоты бластуляции при БНГ за счет остановок развития эмбрионов до 3 суток культивирования. При более низкой частоте бластуляции в группе БНГ частота развития бластоцист из эмбрионов 3 суток культивирования не различалась между группами БНГ (55,3%) и ТПБ (55,7%), что также подтверждает остановку развития эмбрионов до 3 суток культивирования при БНГ.
Сниженная частота бластуляции и большая частота остановок развития эмбрионов до 3 суток культивирования в программах ЭКО свидетельствуют о нарушении ранних этапов эмбриогенеза и отражают закономерность этого процесса при БНГ. Это можно расценивать как возможную причину инфертильности при БНГ и, следовательно, дополнительные методы исследования, часто назначаемые супружеским парам, и длительное эмпирическое лечение неоправданы. Как было показано ранее, в группе БНГ статистически значимо больше средняя длительность бесплодия – 5,7 лет (в подгруппе ВМИ – 6,3 лет), чем в группе ТБП – 4,8 лет.
В группе БНГ (66,7%) отмечалось более высокое качество бластоцист (хорошие бластоцисты: >3, AA, AB, BA по классификации Гарднера) при сравнении с ТПБ (45,8%) и больше программ ЭКО с получением хороших бластоцист при сравнении с ТПБ (65,5% и 43,9% соответственно).
При БНГ значительно реже переносили эмбрионы до 3 суток культивирования включительно по сравнению с ТПБ (23,8% (на 1 сутки – 8,8%, на 3 сутки – 15,0%) и 30,6% (на 1 сутки – 5,6%, на 3 сутки – 25,0%) соответственно) и значительно чаще переносили бластоцисты по сравнению с ТПБ (на 5 сутки – 68,8% и 58,3% соответственно), что может косвенно отражать тенденцию развития эмбрионов при БНГ: после преодоления 3 суток эмбрионы с нормальной частотой развиваются в бластоцисты, причем часто хорошего качества.
Нормальная частота оплодотворения, сниженная частота бластуляции за счет большей частоты остановок развития эмбрионов до 3 суток культивирования и в то же время более высокое качество получаемых бластоцист объясняют патогенез БНГ: зачатие у этих супружеских пар происходит с нормальной частотой, эмбрионы чаще останавливаются в развитии до 3 суток, бластоцисты образуются реже, но часто они хорошего качества, поэтому беременность может наступать, но время до ее достижения увеличивается, при этом возраст и увеличивающаяся с возрастом коморбидность пациентов с БНГ приводят к дополнительному ограничению реализации их репродуктивной функции. ЭКО сокращает время до получения бластоцисты хорошего качества и, соответственно, наступления беременности, то есть является методом патогенетического лечения БНГ. Вышеизложенное является обоснованием целесообразности раннего проведения ЭКО с переносом эмбриона хорошего качества (>3, AA, AB, BA по классификации Гарднера) на 5-6 сутки культивирования пациентам с БНГ.
В группе БНГ (57,5%) отмечалось больше программ ЭКО с отменой переноса эмбрионов, чем в группе ТПБ (34,1%), в основном из-за назначения ПГТ-А (47,7%).
Несмотря на то что в группе БНГ (68,1%) отмечалось значительно больше программ ЭКО с криоконсервацией эмбрионов, чем в группе ТПБ (53,7%), не было обнаружено различий в количестве криоконсервированных эмбрионов из расчета на цикл овариальной стимуляции (БНГ – 3,7 и ТПБ – 3,4) и доле криоконсервированных бластоцист (БНГ – 70,0% и ТПБ – 66,4%) между двумя группами.
Интегральный показатель используемости бластоцист (Utilization rate) при БНГ (40%) был ниже, чем при ТПБ (44%), что является отражением более низкой частоты бластуляции в группе БНГ при прочих равных условиях [14].
Выявленные нарушения раннего эмбриогенеза у пациентов с БНГ обусловили необходимость научного поиска возможных причин и факторов нарушения ранних этапов эмбриогенеза, прежде всего наиболее консервативных – генетических, у пациентов с БНГ.
Считается, что активация эмбрионального генома (embryonic genome activation, EGA) начинается на стадии 4-х бластомеров, поэтому остановка развития эмбриона на стадии дробления, то есть на 1-3 сутки, вероятно, обусловлена ооцитарным фактором, а нарушение его развития между стадиями компактизации морулы и формирования бластоцисты, то есть на 4-6 сутки, – с геномом эмбриона [15].
ПГТ-А эмбрионов проводилось по показаниям: 3 и более безуспешные попытки переноса эмбрионов и/или 2 и более самопроизвольных прерывания беременности в анамнезе. ПГТ-А в группе БНГ (62,7%) проводилось в более чем половине случаев и чаще, чем при ТПБ (14,3%), что закономерно при неустановленной этиологии бесплодия и безуспешных попытках забеременеть как самостоятельно, так и с использованием методов вспомогательных репродуктивных технологий. Однако данным ПГТ-А, частота выявления эуплоидных эмбрионов не различалась между группами БНГ (41,7%) и ТПБ (40,0%), то есть анеуплодия эмбрионов не является фактором, обуславливающим развитие БНГ. Отсутствие различий между группами БНГ и ТПБ в частоте выявления эуплоидных эмбрионов по данным ПГТ-А свидетельствует о нецелесообразности рутинного проведения ПГТ-А при БНГ. Это увеличивает время до переноса эмбриона и, соответственно, достижения беременности.
По результатам полноэкзомного секвенирования у 6 исследованных супружеских пар с БНГ не было обнаружено патогенных и вероятно патогенных вариантов, имеющих отношение к фенотипу пациентов, а также случайных (вторичных) находок (согласно списку генов ACMG). В двух супружеских парах были выявлены варианты неясной клинической значимости, связь которых с БНГ маловероятна.
Необходим дальнейший научный поиск молекулярных механизмов нарушения ранних этапов эмбриогенеза, включающий, в первую очередь, исследование качества гамет, у пациентов с БНГ.
Заключение
Полученные данные свидетельствуют о том, что супружеским парам с БНГ нецелесообразно рекомендовать расширенное диагностическое обследование и эмпирическое лечение, а необходимо раннее проведение ЭКО с переносом эмбриона хорошего качества (>3, AA, AB, BA) на 5-6 сутки культивирования, при этом нецелесообразно проводить оплодотворение методом ИКСИ, проводить ПГТ-А (Рисунок 1).
Список литературы
- Practice Committee of the American Society for Reproductive Medicine. Electronic address: asrm@asrm.org; Practice Committee of the American Society for Reproductive Medicine. Evidence-based treatments for couples with unexplained infertility: a guideline. Fertil Steril. 2020;113(2):305-322. Doi: 10.1016/j.fertnstert.2019.10.014
- ACOG Committee. Infertility workup for the women’s health specialist: ACOG Committee Opinion, Number 781. Obstet Gynecol. 2019;133(06):e377-e384.
- Buckett W, Sierra S. The management of unexplained infertility: an evidence-based guideline from the Canadian Fertility and Andrology Society. Reprod Biomed Online. 2019;39(4):633-640. Doi: 10.1016/j.rbmo.2019.05.023
- Zegers-Hochschild F, Adamson GD, Dyer S, et al. The International Glossary on Infertility and Fertility Care, 2017. Fertil Steril. 2017;108(3):393-406. Doi: 10.1016/j.fertnstert.2017.06.005
- Halassy S, Mikhael S, Chorich LP, et al. Hall establishing the link between genetic variations of estrogen receptor 2 and unexplained infertility. J Endocr Soc. 2020;4(1-S):SUN-738. Doi: 10.1210/jendso/bvaa046.855
- Foucaut A-M, Faure C, Julia C, Czernichow S, Levy R, Dupont C; ALIFERT Collaborative Group. Sedentary behavior, physical inactivity and body composition in relation to idiopathic infertility among men and women. PLoS One. 2019;14(4):e0210770. Doi: 10.1371/journal.pone.0210770
- Duffy JMN, Adamson GD, Benson E, et al. Top 10 priorities for future infertility research: an international consensus development study. Hum Reprod. 2020;35(12):2715-2724. Doi: 10.1093/humrep/deaa242
- World Health Organization. (2010). WHO laboratory manual for the examination and processing of human semen, 5th ed. World Health Organization.
- Yücel B, Kelekci S, Demirel E. Decline in ovarian reserve may be an undiagnosed reason for unexplained infertility: a cohort study. Arch Med Sci. 2018;14(3):527-531. Doi: 10.5114/aoms.2016.58843
- Abrahami N, Izhaki I, Younis JS. Do young women with unexplained infertility show manifestations of decreased ovarian reserve? J Assist Reprod Genet. 2019;36(6):1143-1152. Doi: 10.1007/s10815-019-01467-0
- Кучеренко В.З., ред. Применение методов статистического анализа для изучения общественного здоровья и здравоохранения: учебное пособие. М: ГЭОТАР-Медиа;2011:256.
- Merviel P, Labarre M, James P, et al. Should intrauterine inseminations still be proposed in cases of unexplained infertility? Retrospective study and literature review. Arch Gynecol Obstet. 2022;305(5):1241-1254. Doi: 10.1007/s00404-021-06351-w
- Bosch E, Alviggi C, Lispi M, et al. Reduced FSH and LH action: implications for medically assisted reproduction. Hum Reprod. 2021;36(6):1469-1480. Doi: 10.1093/humrep/deab065
- ESHRE Special Interest Group of Embryology and Alpha Scientists in Reproductive Medicine. The Vienna consensus: report of an expert meeting on the development of ART laboratory performance indicators. Reprod Biomed Online. 2017;35(5):494-510. Doi: 10.1016/j.rbmo.2017.06.015
- Sfakianoudis K, Maziotis E, Karantzali E, et al. Molecular Drivers of Developmental Arrest in the Human Preimplantation Embryo: A Systematic Review and Critical Analysis Leading to Mapping Future Research. Int J Mol Sci. 2021;22(15):8353. Doi: 10.3390/ijms22158353
Таблица 1. Средние значения эмбриологических показателей программ экстракорпорального оплодотворения у пациентов групп бесплодия неясного генеза и трубно-перитонеального фактора бесплодия
| Показатель | БНГ (n=93, m=108) | ТПБ (n=45, m=49) | t-критерий Стьюдента |
| *%Зрелых ооцитов = кол-во зрелых ооцитов/кол-во аспирированных ооцитов * 100% | 73,79 (4,44) | 75,13 (7,96) | t=0,41 |
| %Двупронуклеарных зигот = кол-во зигот/кол-во зрелых ооцитов * 100% | 76,46 (4,64) | 78,09 (7,26) | t=0,58 |
| метод oплодотворения – ЭКО (%) | 19,7 | 41,7 | |
| метод oплодотворения – ИКСИ (%) | 80,3 | 58,3 | |
| % Бластуляции = кол-во бластоцист/кол-во зигот * 100% | 45,53 (6,80) | 57,31 (11,44) | t=2,56* |
*t≥2 (p<0,05) – есть статистически значимые различия между группами
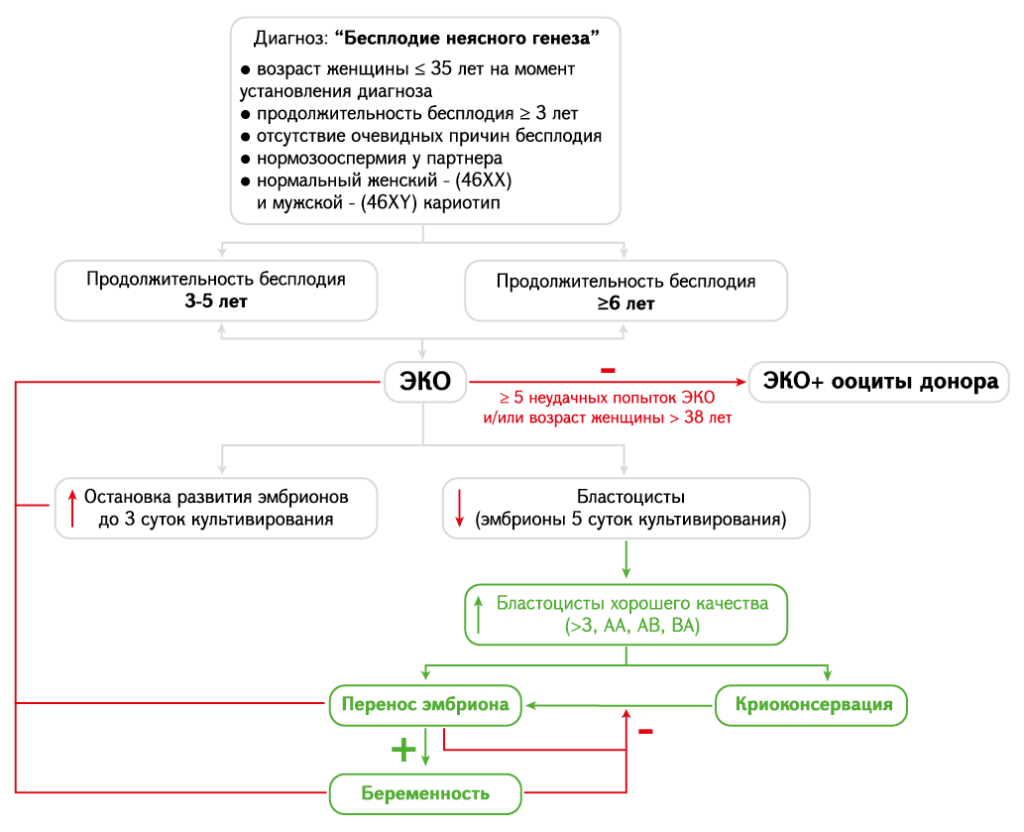
Рисунок 1. Алгоритм диагностики и патогенетического лечения пациентов с бесплодием неясного генеза, разработанный на основе полученных данных