Предлучевая подготовка для проведения лучевой терапии больных раком легкого: современные подходы
Краткий обзор литературы
Лусине М. Мурадян,* Паруйр М. Антонян
Отделение радиационной онкологии, Национальный центр онкологии им. В.А. Фанарджяна, Ереван, Армения
Медицинский центр “ИРА Медикал Груп”, Ереван, Армения
АБСТРАКТ
Лучевая терапия (ЛТ) является основным методом лечения у 50-80% больных раком легкого (РЛ), поскольку из общего числа пациентов с данной онкологической патологией только 2025% подвергаются оперативному вмешательству. Это связано на ранних стадиях заболевания с «функциональной» несостоятельностью пациента, либо отказом его от операции, а на более поздних – с большими размерами опухоли, наличием метастазов. Целью ЛТ является уничтожение клеток, из которых состоит опухоль с применением высоких доз излучения с меньшим повреждением нормальных тканей, реализация которого возможна только с помощью применения высокотехнологического радиотерапевтического оборудования. Совершенствование лучевых методов лечения можно определить двумя основными направлениями – уменьшение объемов облучения за счет максимального исключения из зоны облучения нормальных тканей и увеличение доз, приводящих к повреждению опухоли. Этого можно достигнуть при помощи конформной лучевой терапии (КЛТ), которая предполагает формирование такого дозного поля, трехмерная форма и внутренняя структура которого максимально соответствуют форме и структуре облучаемой мишени в теле пациента, при этом дозы облучения здоровых окружающих тканей заведомо ниже толерантных значений. Современными технологиями КЛТ являются облучение с модуляцией интенсивности пучка излучения (Intensity-Modulated Radiation Therapy, IMRT), ЛТ под управлением по изображениям (Image-Guided Radiation Therapy, IGRT), ЛТ с использованием системы респираторной синхронизации, управляющей соответствующими смещениями пучка излучения. Предлучевая подготовка с использованием объемного планирования РЛ включает в себя: получение анатомо-топографической информации об опухоли и прилежащих структурах, выбор источника и условий облучения, введение анатомотопографического изображения в планирующую систему, создание программ объемного планирования для виртуальной симуляции, практическую реализацию выбранной методики ЛТ и условий облучения, контроль качества выполнения предлучевой подготовки. Таким образом, оптимизация методов клинической топометрии на этапе предлучевой подготовки больных РЛ с использованием современного оборудования и новейших методик, обеспечивающих точное пространственно-дозиметрическое распределение энергии в патологическом очаге, способствует дальнейшему прогрессу в лечении тяжелой онкологической патологии.ая резекция правого надпочечника.
Ключевые слова: предлучевая подготовка, рак легкого, конформная лучевая терапия, IMRT, IGRT, респираторная синхронизация.
DOI 0.54235/27382737-2022.v2.2-17
ВВЕДЕНИЕ
Проблема рака легкого (РЛ) является одной из наиболее важных и сложных в современной онкологии. Это обусловлено трудностями своевременной диагностики и недостаточной эффективностью лечения. Заболеваемость РЛ является не только медицинской, но и социальной проблемой. По данным обновленной версии базы мировых данных по раку GLOBOCAN 2012, поддерживаемой Международным агентством по изучению рака (International Agency for Research on Cancer, IARC), Всемирной организации здравоохранения (ВОЗ), первое место как среди вновь диагностируемых злокачественных новообразований, так и среди причин смерти от онкологии занимает РЛ – 1.8 млн человек, что составляет 13% от общего числа раков [1]. Лучевая терапия (ЛТ) занимает первое место по частоте и широте спектра применения среди трех основных методов лечения злокачественных новообразований – хирургического, лучевого и химиотерапии. В качестве основного метода лечения у 50-80% больных РЛ является ЛТ, поскольку из общего числа пациентов с данной онкологической патологией только 20-25% подвергаются оперативному вмешательству. Это связано на ранних стадиях заболевания с «функциональной» несостоятельностью пациента, либо отказом его от операции, а на более поздних – с большими размерами опухоли, наличием регионарных и отдаленных метастазов [2-6].
На сегодняшний день ЛТ является высокоэффективным методом противоопухолевого лечения, целью которого является уничтожение клеток, из которых состоит патологический очаг/ опухоль с применением высоких доз излучения с меньшим повреждением нормальных тканей и критических структур, реализация которого возможна только с помощью применения высокотехнологического радиотерапевтического оборудования. В современной онкологии совершенствование лучевых методов лечения можно определить двумя основными направлениями – уменьшение объемов облучения за счет максимального исключения из зоны облучения нормальных тканей и увеличение доз, приводящих к повреждению опухоли. Однако ЛТ РЛ всегда сталкивалась с проблемой между необходимостью подведения высоких суммарных очаговых доз к опухоли и риском развития тяжелых лучевых повреждений, таких как, например, лучевых пневмонитов, эзофагитов, фиброзу [7-10]. 90-е годы XX века стали переломными в области дозиметрического планирования и способов облучения в ЛТ, обусловленные стремительным развитием радиотерапевтической аппаратуры, дозиметрического и программного обеспечения [11,12]. Согласно заключению экспертов ВОЗ, успех ЛТ примерно на 50% зависит от радиочувствительности опухоли, на 25% – от аппаратного оснащения и на 25% – от выбора рационального плана лечения и точности его воспроизведения от сеанса к сеансу облучения [13].
Появление в последние годы современного радиотерапевтического оборудования, развитие диагностической и радиотерапевтической техники, все более широкое внедрение рентгеновских компьютерных томографов в практику дозиметрического планирования, применение современных высокопродуктивных алгоритмов расчета доз привели к развитию новой методики облучения – конформной лучевой терапии (КЛТ). КЛТ бурно развивающееся и наиболее перспективное направление современной ЛТ, предполагающего формирование такого дозного поля, трехмерная форма и внутренняя структура которого максимально соответствует форме и структуре облучаемой мишени в теле пациента, при этом дозы облучения здоровых окружающих тканей заведомо ниже толерантных значений. В основе методики – трехмерная локализация и топометрия мишени, трехмерное планирование и трехмерная технология доставки запланированной дозы излучения к мишени [14]. Наиболее современной технологией КЛТ является облучение с модуляцией интенсивности пучка излучения (Intensity-Modulated Radiation Therapy, IMRT), поскольку обеспечивает оптимальное дозное распределение излучения в мишени и минимум повреждений окружающих тканей. Для модуляции интенсивности пучка излучения используют различные средства от стандартных физических болюсов до сканирования узким пучком фотонов, энергия и плотность потока которых меняется в ходе лечения. Однако чаще всего пространственная модуляция интенсивности пучка фотонов обеспечивается с помощью многолепесткового коллиматора.
Для локального облучения РЛ с целью еще большего снижения лучевой нагрузки на здоровые ткани применяется ЛТ под управлением по изображениям (Image-Guided Radiation Therapy, IGRT). Как известно, точность доставки дозы излучения к мишени лимитируется в основном погрешностями определения локализации и формы мишени. Смещения и изменения формы мишени, происходящие по разным причинам между очередными сеансами облучения, совместно с ошибками при повторных укладках (позиционировании) больного, усугубляют эти погрешности. Поэтому ежедневный контроль мишени средствами медицинской визуализации до очередного сеанса облучения позволяет снизить эти погрешности. Однако желательно подобный контроль проводить не только до, но и непосредственно в ходе облучения [14].
Еще при использовании КЛТ было замечено, что при РЛ, расположение опухоли может заметно изменяться, что серьезно осложняет задачу радиационного онколога. Причина этому – движения тела пациента, связанные с дыханием. Подвижность может достигать 2-3 см в зависимости от локализации опухоли легкого, меньше – при центральном раке, больше – при периферическом раке нижней доли легкого. При конформном облучении респираторные движения органов грудной клетки приводят к «размыванию» дозного поля и вследствие этого к повышению частоты лучевых осложнений, особенно радиационно-индуцированных пульмонитов. На помощь приходит ЛТ с использованием системы респираторной синхронизации, управляющей соответствующими смещениями пучка излучения [14]. Управляемая дыханием ЛТ с использованием методики четырехмерной KЛТ (4DRT) позволяет выборочно обрабатывать определенные фазы дыхания с учетом местоположения мишени в соответствии с движением органа и повышать терапевтическую эффективность [15,16]. Большие поля с большим запасом прочности по отношению к целевым объемам обычно использовались для преодоления неопределенностей во время обработки в прошлом [17]. Тем не менее, мишени становятся все меньше и более согласованными с точной локализацией опухоли для усиления контроля над опухолью и снижения риска токсичности. Существует несколько методов уменьшения/сокращения границ, вызванных дыхательным движением. Это методы задержки дыхания, включая активный контроль дыхания (Active Breathing Coordinator, ABC), сжатие живота, технику задержки дыхания на глубоком вдохе (Deep Inspiration Breath Hold, DIBH), метод респираторной синхронизации, ЛТ с отслеживанием опухоли в реальном времени (Real-Time Tracking Radiotherapy, RTRT), метод секвенирования многолепесткового коллиматора (Sеquencing Method of Dynamic Collimators, MLC), кибернож [18-24].
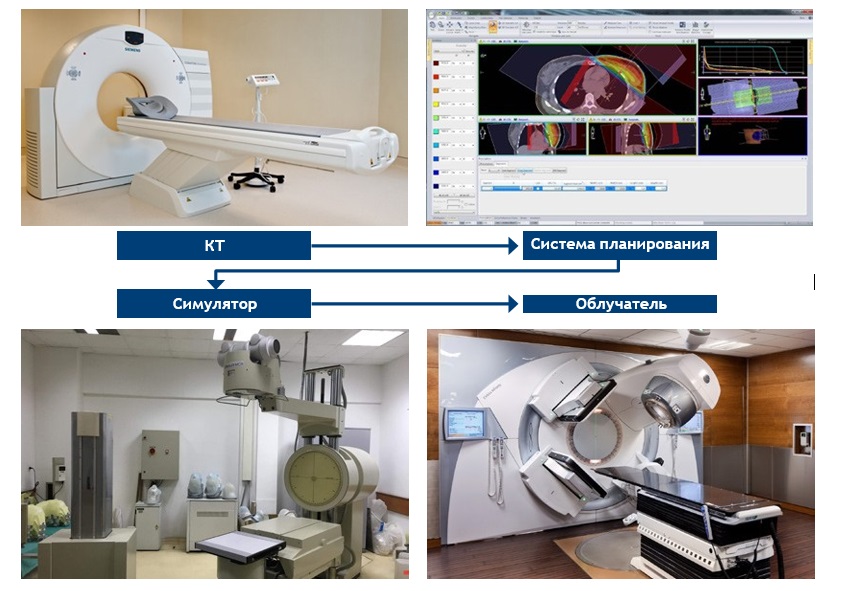
Рис. 1. Комплекс оборудования, предназначенный для проведения предлучевой подготовки
Предлучевая подготовка с использованием объемного планирования РЛ, включает в себя 25:
► получение анатомо-топографической информации об опухоли и прилежащих структурах
► выбор источника и условий облучения
► введение анатомотопографического изображения в планирующую систему
► создание программ объемного планирования для виртуальной симуляции
► практическую реализацию выбранной методики ЛТ и условий облучения
► контроль качества выполнения предлучевой подготовки.
Получение анатомо-топографических данных
После того, как при помощи целого арсенала диагностических методов наличие злокачественного опухолевого процесса было подтверждено, и лечащий врач принял решение о целесообразности проведения курса ЛТ, встает вопрос о получении точных данных о размере и локализации опухоли и ее взаиморасположении по отношению к близлежащим органам и структурам. Стандартным методом визуализации является компьютерная томография (КТ). Исследования КТ проводятся в условиях, тождественных тем, при которых должна проводиться трехмерная КЛТ, что необходимо для точной репродукции последующих лечебных процедур. Лучевой терапевт может расширить объем КТ-исследования, например, добавить к исследованию грудной клетки исследование шеи, но не может его уменьшить, так как для расчета доз исследование должно полностью включать все отделы критического органа. С целью уточнения объема облучения, дополнительно выполняется магнитно-резонансная томография, позитронно-эмиссионная томография [26-28].
Выбор источника и условий облучения
Пациента регистрируют в журнале учета для ЛТ, который постоянно находится в кабинете КТ. Лучевой терапевт осуществляет необходимую укладку пациента на столе томографа. Важнейшим при этом является выбор вспомогательных приспособлений для иммобилизации, применение индивидуальных фиксирующих устройств. Рентгенолаборант наносит на кожу пациента проекции 4 лазеров: двух боковых, продольного и поперечного (аксиального), а также метку для референтной точки. Положение референтной метки при опухолях грудной клетки – середина рукоятки грудины. Зона исследования – от вырезки грудины до нижних отделов легочных синусов включительно (легкие должны войти в уровень исследования полностью).
Введение анатомо-топографического изображения в планирующую систему
После завершения сканирования рентгенолаборант передает данные на планирующую станцию для оконтуривания объемов. Контурирование объемов облучения и критических органов, дозы и режима фракционирования осуществляется лучевым терапевтом. Основные концепции, связанные с выделением объемов облучения, описаны в докладе Международной комиссии по радиационным единицам и измерениям № 50 (ICRU Report 50: Prescribing, Recording and Reporting Photon Beam Therapy. Bethesda, MD, International Commission on Radiation Units and Measurements, 1993). Затем, в процессе планирования медицинскими физиками определяются такие параметры облучения, как: вид и энергию пучка излучения, размеры, направления и количество пучков, относительная доза, приходящаяся на каждый пучок, рассчитывается дозное распределение, рассчитывается целесообразность применения специальных защитных блоков, коллиматоров (для снижения лучевой нагрузки на здоровые структуры).
Создание программ объемного планирования для виртуальной симуляции
Для верификации выбранного объема облучения и его точного воспроизведения проводится повторная симуляция (виртуальная симуляция), которая осуществляется лучевым терапевтом, рентгенолаборантом в присутствии медицинского физика в соответствии с готовым планом ЛТ. Для этой цели применяют специальное оборудование, которое позволяет полностью воспроизвести условия облучения и наглядно визуализировать облучаемую область. Сегодня для этих целей применяют рентгеновские симуляторы, симуляторы-КТ и КТ-симуляторы.
► Рентгеновский симулятор представляет собой рентгеновский диагностический аппарат, который в точности повторяет все параметры и конструктивные особенности терапевтических аппаратов, а также имеет световые дальномеры и маркеры размеров поля облучения.
► Симулятор-КТ – это тот же самый рентгеновский симулятор, только оснащенный дополнительной секцией КТ, что позволяет точным образом имитировать процесс облучения самой сложной конфигурации.
► КТ-симулятор – это компьютерный томограф, который оснащен функцией виртуальной компьютерной симуляции для виртуальной имитации процесса облучения.
Пациента укладывают на стол симулятора в соответствии с предварительно нанесенными метками, так, чтобы положение во время разметки и положение во время симуляции (а значит и во время последующего лечения) были абсолютно идентичными. Затем проводят имитацию процесса облучения в соответствии с параметрами предварительно составленного плана, что дает возможность наглядно определить облучаемую область. Таким образом, процесс симуляции позволяет сопоставить предварительно составленный на компьютере план облучения с реальным процессом лечения на терапевтическом аппарате.
Практическая реализация выбранной методики лучевой терапии и условий облучения
Первый сеанс облучения осуществляется обязательно в присутствии лучевого терапевта и медицинского физика. Учитывая трудоемкость и сложность укладок, в данном процессе должны быть задействованы как минимум два лаборанта.
Контроль качества выполнения предлучевой подготовки осуществляется независимым внешним аудитом или группой независимых экспертов для обеспечения качества ЛТ. Гарантия качества в ЛТ – это комплексная программа соблюдения физико-технических, дозиметрических, клинических, кадровых и организационных мероприятий с учетом индивидуальных особенностей организма больного. Она включает деятельность в радиотерапевтическом учреждении от момента поступления пациента до момента выписки и дальнейшее наблюдение с целью повышения эффективности лечения.
В отделении радиационной онкологии Национального центра онкологии им. В.А. Фанарджяна проводистя вся технологическая цепочка предлучевой подготовки в соотвествии с общепринятыми протоколами лечения. В отделении проводится трехмерная КЛТ на линейном ускорителе фирмы ELEKTA, Швеция. В настоящем ведутся работы по созданию нового модернизированного радиологического центра, что позволит перейти на высокий уровень сложности радиотерапевтического комплекса.
Таким образом, оптимизация методов клинической топометрии на этапе предлучевой подготовки больных РЛ с использованием современного оборудования и новейших методик, обеспечивающих точное пространственно-дозиметрическое распределение энергии в патологическом очаге и способствует дальнейшему прогрессу в лечении тяжелой онкологической патологии.
ЛИТЕРАТУРА
- CLOBOCAN 2012. Estimated cancer incidence, mortality and prevalence worldwide in 2012. World Health Organization, 2012, https://publications.iarc.fr/Databases/ Iarc-Cancerbases/GLOBOCAN-2012-Estimated-CancerIncidence-Mortality-And-Prevalence-Worldwide-In2012-V1.0-2012, Accessed June, 2022
- Hayman JA, Abrahamse PH, Lakhani I, Earle CC, Katz SJ. Use of palliative radiotherapy among patients with metastatic non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 2007;69(4):1001-1007
- Чиссов ВИ. Онкология. Нац. рук-во. ГЭОТАР-Мед., 2008.С.128-168
- Smith SL, Palma D, Parhar T, Alexander CS, Wai ES. Inoperable early stage non-small cell lung cancer: comorbidity, patterns of care and survival. Lung Cancer. 2011;72(1):39-44
- Faria SL. Role of radiotherapy in metastatic non-small cell lung cancer. Front Oncol. 2014;4:229
- Slotman BJ, Van Tinteren H, Praag JO et al. Use of thoracic radiotherapy for extensive stage small-cell lung cancer: A phase 3 randomised controlled trial. Lancet. 2015;385(9962):36-42
- Курсова ЛВ. Лучевые повреждения органов грудной клетки у больных раком легкого. Рос Онкол Журн. 2010;6:51-55
- Пасов ВВ. Поздние лучевые повреждения органов грудной клетки. Сиб Онкол Журн. 2009;6:58-61
- Werner-Wasik M, Yorke E, Deasy J, Nam J, Marks LB. Radiation dose-volume effects in the esophagus. Int J Radiat Oncol Biol Phys. 2010;76(3S):S86-93
- Giridhar P, Mallick S, Rath GK, Julka PK. Radiation induced lung injury: prediction, assessment and management. Asian Pac J Cancer Prev. 2015;16(7):2613-2617
- Бойко АВ. Эволюция идеологии лучевой терапии на основе ее коренного технического перевооружения. Мед Радиол Радиац Безоп. 2006;51(1):46-53
- Трофимова ОП. Прошлое и настоящее лучевой терапии в онкологии. Клин Онкогематол Фундам Исслед Клин Практ. 2013;6(4):355-364
- Дарьялова СЛ, Бойко АВ, Черниченко АВ. Современные возможности лучевой терапии злокачественных опухолей. Рос Онкол Журн. 2000;1:48-55
- Костылев ВА, Наркевич БЯ. Медицинская физика. Москва: «Медицина», 2008. 464 с
- Underberg RWM, Lagerwaard FJ, Slotman BJ, Cuijpers JP, Senan S. Benefit of respiration-gated stereotactic radiotherapy for stage I lung cancer: an analysis of 4DCT datasets. Int J Radiat Oncol Biol Phys. 2005;62(2):554-560
- George R, Ramakrishnan V, Siebers J V, Chung TD, Keall PJ. Investigation of patient, tumour and treatment variables affecting residual motion for respiratory-gated radiotherapy. Phys Med Biol. 2006;51(20):5305-5319
- Purdy JA. Current ICRU definitions of volumes: limitations and future directions. Semin Radiat Oncol. 2004;14(1):27-40
- Hanley J, Debois MM, Mah D et al. Deep inspiration breath-hold technique for lung tumors: the potential value of target immobilization and reduced lung density in dose escalation. Int J Radiat Oncol Biol Phys. 1999;45(3):603-611
- Wong JW, Sharpe MB, Jaffray DA et al. The use of active breathing control (ABC) to reduce margin for breathing motion. Int J Radiat Oncol Biol Phys. 1999;44(4):911-919
- Cheung PCF, Sixel KE, Tirona R, Ung YC. Reproducibility of lung tumor position and reduction of lung mass within the planning target volume using active breathing control (ABC). Int J Radiat Oncol Biol Phys. 2003;57(5):1437-1442
- Mah D, Hanley J, Rosenzweig KE, et al. Technical aspects of the deep inspiration breath-hold technique in the treatment of thoracic cancer. Int J Radiat Oncol Biol Phys. 2000;48(4):1175-1185
- Ohara K, Okumura T, Akisada M, et al. Irradiation synchronized with respiration gate. Int J Radiat Oncol Biol Phys. 1989;17(4):853-857
- Onimaru R, Shirato H, Fujino M, et al. The effect of tumor location and respiratory function on tumor movement estimated by real-time tracking radiotherapy (RTRT) system. Int J Radiat Oncol Biol Phys. 2005;63(1):164-169
- Seppenwoolde Y, Berbeco RI, Nishioka S, Shirato H, Heijmen B. Accuracy of tumor motion compensation algorithm from a robotic respiratory tracking system: a simulation study. Med Phys. 2007;34(7):2774-2784
- Артемова НА, Минайло ИИ, Тарутин ИГ. Программа гарантий лучевой терапии. Онкол Журн. 2007;1(1):24-42
- Хоружик СА. Основы КТ-визуализации. Часть II: Постпрессинговая обработка изображений. 2011;4:52-56
- Konert T, Vogel W, MacManus MP et al. PET/CT imaging for target volume delineation in curative intent radiotherapy of non-small cell lung cancer: IAEA consensus report 2014. Radiother Oncol. 2015;116(1):27-34
- Schmidt MA, Payne GS. Radiotherapy planning using MRI. Phys Med Biol. 2015;60(22):R323-R361