Ներսես Քարամյան,1,2,* Միքայել Առուստամյան,1 Սևանա Աբնուսի,2 Վահե Տեր-Մինասյան,2
1«ԻՐԱ Մեդիքլ Գրուպ» բժշկական կենտրոն, Երևան, Հայաստան
2Ուռուցքաբանության ամբիոն, ՀՀ ԱՆ ակադ. Ս.Ավդալբեկյանի անվան առողջապահության ազգային ինստիտուտ, Երևան, Հայաստան
Ամփոփագիր
Նպատակը. Վերլուծելով հիվանդների ապրելիության ցուցանիշները, հնարավոր բարդությունները և կյանքի որակը՝ ուսումնասիրել կրկնակի ճառագայթային բուժման (ՃԲ) նշանակման նպատակահարմարությունը տարբեր պաթոլոգիաների ժամանակ։
Նյութեր և մեթոդներ. Կատարվել է 1 կլինիկայի փորձի վերլուծություն 1050 պացիենտների տվյալների հիման վրա, ովքեր 2019-2021 թթ. ստացել են ՃԲ «ԻՐԱ ՄԵդիքլ Գրուպ» բժշկական կենտրոնում։ Վերլուծության համար առանձնացվել է 42 պացիենտ, ովքեր ստացել են ՃԲ կրկնակի կուրս (ռեիռադիացիա), ինչը կազմում է ընդհանուր պացիենտների 4%-ը։ Հիվանդների տարիքի մեդիանան կազմել է 60,5 տ. (տիրույթ՝ 22-81), 17 տղամարդ և 25 կին: Ուռուցքներն ըստ տեղակայման բաշխվել են հետևյալ կերպ. կենտրոնական նյարդային համակարգի առաջնային քաղցկեղ (n = 12), գլխուղեղի երկրորդային մետաստատիկ ախտահարում (n = 8), գինեկոլոգիական (n = 6), գլուխ-պարանոց (n = 5), ոսկրային համակարգի մետաստատիկ ախտահարում (n = 3), կրծքագեղձի քաղցկեղ (n = 3), այլ տեղակայման (n = 5)։ Ըստ հիվանդության փուլի հիվանդները բաշխվել են հետևյալ կերպ. III՝ 6 պացիենտ, IV՝ 30, չդասակարգվող՝ 6: Երկու կուրսերի միջև եղած միջակայքի մեդիանան կազմել է 34,5 ամիս (տիրույթ՝ 1,5-252): Երկու կուրսերի գումարային համարժեք չափաբաժնի մեդիանան կազմել է՝ 99Գր (տիրույթ՝ 56-121)։ Այս ցանկից գլխուղեղի և ոսկրային համակարգի երկրորդային ախտահարմամբ հիվանդներին բացառելու դեպքում երկու կուրսերի գումարային համարժեք չափաբաժնի մեդիանան կկազմի 102Գր (տիրույթ՝ 84-121): Հիվանդների հսկողության մեդիանան կրկնակի ՃԲ կուրսից հետո կազմել է 9 ամիս (տիրույթ՝ 1-29,5):
Արդյունքներ. Մահացած հիվանդների ապրելիության մեդիանան կազմել է 6,5 ամիս (տիրույթ՝ 1-23)։ Կրկնակի ՃԹ ստացած 42 պացիենտներից 7-ի մոտ, ովքեր ի սկզբանե ունեցել են Կառնոֆսկու ցածր գործակից (60%), ապրելիությունը կազմել է առավելագույնը 3,5 ամիս։ Այդ 7-ին վերլուծությունից բացառելու դեպքում մնացած հիվանդների ապրելիության մեդիանան կկազմի 10 ամիս (տիրույթ՝ 4-23)։ 2021 թ. դեկտեմբերի 31-ի դրությամբ ողջ է եղել 21 պացիենտ, որոնց հսկողության մեդիանան կազմել է 11 ամիս (տիրույթ՝ 5-29,5)։ Գնահատվել են նաև հիվանդների հետճառագայթային կյանքի որակը և բարդությունների քանակը։ Կյանքի որակի նվազեցում և բուժման հետ կապված մահվան դեպքեր չեն արձանագրվել։
Եզրակացություն. Տվյալ պրոսպեկտիվ հետազոտության արդյունքները ցույց են տալիս, որ, նորագույն տեխնոլոգիաներով կրկնակի ռադիոթերապիայի կուրս անցկացնելով, կարելի է հասնել հիվանդների ապրելիության և կյանքի որակի բարձրացման։ Այդ նորագույն տեխնոլոգիաների շնորհիվ կարելի է պլանավորել նույնիսկ երկրորդ կուրատիվ դոզա։ Բուժական կամ նույնիսկ ամոքիչ (պալիատիվ) ռադիոթերապիայի կրկնակի կուրս նախատեսելիս պետք է հաշվի առնել մի շարք գործոններ՝ կապված նախկինում ստացած բուժման և հիվանդի անհատական բնութագրերի հետ: Անհրաժեշտ է կատարել հիվանդների մանրակրկիտ ընտրութուն՝ հաշվի առնելով վերոնշյալ գործոնները։ Հետազոտությունն ավարտելուց հետո նախատեսվում է մշակել կրկնակի ճառագայթման ենթակա պացիենտների ընտրության չափանիշների ուղեցույց։
Հիմնաբառեր. ուռուցք, քաղցկեղ, ճառագայթային թերապիա, ռեիռադիացիա (կրկնակի ճառագայթման կուրս)
DOI:10.54235/27382737-2022.v2.1-48
Ներածություն
Հիվանդների մոտ նախկինում ճառագայթված ծավալում ռեցիդիվի զարգացումն առանց հիվանդության համակարգային բնույթ կրելու, ինչպես նաև երկրորդային ուռուցքի առաջացումը որոշ դեպքերում պահանջում են նախկինում ճառագայթված ծավալի կրկնակի ճառագայթում (ռեիռադիացիա)։ Նախկինում համարվում էր, որ մեկ անատոմիական գոտին կյանքի ընթացքում կարող է ճառագայթվել մեկ անգամ (հաշվի առնելով նորմալ հյուսվածքների տոլերանտության շեմը) և կրկնակի ճառագայթման հարցը չէր քննարկվում (կատարվել էին միայն շատ սահմանափակ քանակով հետազոտություններ, որոնք ունեցել էին բացասական արդյունքներ)։ Դա պայմանավորված էր նաև այն հանգամանքով, որ 2D տեխնոլոգիաները հնարավորություն չէին տալիս լիարժեք պաշտպանել ուռուցքի շրջակա առողջ հյուսվածքները և կարող էին հանգեցնել ծանր բարդությունների։ Վերջին տասնամյակներում ճառագայթաբուժության (ՃԲ) տեխնիկական հնարավորությունների (IMRT, IGRT, VMAT, Proton Therapy) և ռադիոբիոլոգիայի զարգացմանը զուգահեռ ավելացել է նմանատիպ հրապարակումների քանակը, որոնք սակայն հիմնականում հետահայաց (ռետրոսպեկտիվ) հետազոտություններ են և նմանատիպ հետազոտությունների ապացուցողական մակարդակը չի կարող համեմատվել առաջին անգամ ճառագայթման ցուցումների հետ, որտեղ կան լայն հետազոտությունների հիման վրա հաստատված ուղեցույցներ։ Այնուամենայնիվ, ռեիռադիացիան կարող է ոչ միայն լինել որպես ամոքիչ (պալիատիվ) բուժում, այլև հնարավորություն է տալիս հասնելու հիվանդության երկարատև տեղային հսկողության։ Ներկայումս բուժական մոտեցումները և տեխնիկական հնարավորությունները թույլ են տալիս երկրորդ անգամ ճառագայթել ցանկացած տեղակայման ուռուցք, ընդհուպ մինչև երկրորդ կուրատիվ դոզա։ Այն հիմնականում կատարվում է այլընտրանքային տարբերակների բացակայության պարագայում։ Շատ դեպքերում վիրաբուժական միջամտությունը դժվարանում է նաև հետճառագայթային ֆիբրոզի հետևանքով։ Քիմիաթերապիայի սահմանափակումներ կարող են հանդիսանալ հիվանդի ընդհանուր վիճակը և ռեցիդիվի զգայունության բացակայությունը քիմիոպրեպարատների նկատմամբ։
Պետք է բաղդատել հիվանդի առողջությանը սպառնացող պոտենցիալ վտանգն ու կրկնակի ճառագայթման ժամանակ կյանքի որակի նվազման ռիսկը և սպասվող բուժական արդյունքը։
Բուժական կամ նույնիսկ ամոքիչ ՃԲ-ի կրկնակի կուրս նախատեսելիս պետք է հաշվի առնել մի շարք գործոններ.
- առաջին ՃԲ-ի ժամանակ ստացած չափաբաժինը (EQD2), ճառագայթված ծավալը,
- բուժման ժամանակ համակցված քիմիաթերապիայի կիրառումը,
- երկու կուրսերի միջև եղած ժամանակահատվածը,
- ճառագայթման ծավալում գտնվող նորմալ հյուսվածքները,
- առաջին ճառագայթումից հետո առաջացած վաղ և ուշ հետճառագայթային փոփոխությունները,
- հիվանդի ընդհանուր վիճակի ծանրությունը,
- բուժման այլընտրանքային միջոցների կիրառման հնարավորությունը:
Ակնհայտ է, որ այն դեպքերում, երբ առաջին ճառագայթման ժամանակ հյուսվածքի տոլերանտության շեմը (ՏՇ) գերազանցվել է, ինչը հանգեցրել է օրգանի ֆունկցիայի կորստի (կամ սպասվում է դրա կորուստ), ցանկալի չէ կրկնակի ճառագայթել այդ ծավալը։
Հիվանդները, որոնց մոտ հիվանդության կրկնությունը եղել է բուժված ծավալում (V95=95%) առաջին ՃԲ-ից հետո 6 ամսվա ընթացքում, որպես կանոն, ունենում են ճառագայթակայուն (ռադիոռեզիստենտ) ուռուցք և չեն համարվում կրկնակի ՃԲ-ի թեկնածու։ Հիվանդության այսպիսի ընթացքը ենթադրում է, որ ուռուցքում կան ռադիոռեզիստենտ կլոններ, որոնցից և զարգանում է հիվանդության կրկնությունը, հետևաբար այս հիվանդների մոտ բուժական արդյունքը կլինի սահմանափակված։
Կոտորակման (ֆրակցիոնացման) տարբեր ռեժիմների համեմատության համար պետք է վերահաշվարկել այդ չափաբաժինները 2Գր ֆրակցիոնացմամբ համարժեք չափաբաժնի (էկվիվալենտ դոզայի՝ EQD2) հետ: Դրա հետ մեկտեղ պետք է օգտագործել գծային-քառակուսի մոդելը (LQ model) հետևյալ α/β ցուցանիշներով. վաղ ռեակցիաների համար՝ 10, ուշ ռեակցիաների համար՝ 3։
ՃԲ կուրս նախատեսելիս պետք է հաշվի առնել շրջակա կառույցների անատոմոֆունկցիոնալ կառուցվածքը։
Բոլոր հյուսվածքները, կախված իրենց անատոմիական, հյուսվածաբանական, ցիտոարխիտեկտոնիկական առանձնահատկություններից, ռադիոկենսաբանության տեսանկյունից օրգանի ֆունկցիոնալ միավորի կառուցվածքից, դասակարգվում են որպես հաջորդական (serial), զուգահեռ (parallel) և խառը հաջորդական-զուգահեռ (serial-parallel) օրգանների։ Հաջորդական օրգաններ են համարվում ողնուղեղը, տեսողական նյարդերը և դրանց խաչվածքը, ուղեղաբունը։ Զուգահեռ օրգաններ են թոքերը, երիկամները, թքագեղձերը, լյարդը։ Խառը կառուցվածքով օրգան է, օրինակ, սիրտը, որտեղ կառուցվածքային տարրերից սրտամկանն ունի հաջորդական կառուցվածք, իսկ պսակաձև զարկերակները՝ զուգահեռ։ Եթե հաջորդական օրգանների ֆունկցիոնալ միավորի նույնիսկ փոքր հատվածը ստանա ՏՇ-ից բարձր չափաբաժին, ապա ամբողջ օրգանը կկորցնի իր ֆունկցիան։ Մինչդեռ զուգահեռ օրգանների պարագայում կարևոր է ճառագայթվող ծավալը, և օրգանը կորցնում է իր ֆունկցիան մեծ ծավալի ճառագայթման պարագայում։ Կախված օրգանի ստացած չափաբաժնից և դրանում կատարված հետճառագայթային անատոմոֆունկցիոնալ վերափոխումներից՝ որոշ օրգաններ ժամանակի ընթացքում վերականգնում են իրենց ռադիոռեզիստենտությունը, իսկ մի շարք օրգաններում այդ փոփոխությունները լինում են մշտական։ Ներկայումս կրկնակի ճառագայթման նկատմամբ հյուսվածքների ՏՇ-երի վերաբերյալ կան որոշակի պատկերացումներ՝ հիմնված կենդանիների վրա կատարված փորձերի և սահմանափակ թվով կլինիկական հետազոտությունների վրա։ Հիմնական կենսական կարևոր օրգանների կրկնակի ճառագայթման նկատմամբ տոլերանտության մասին տվյալները հետևյալն են.
Ողնուղեղի ռեիռադիացիայի վերաբերյալ կան մի շարք փորձարարական տվյալներ. դրա ՏՇ-ն տարբեր է պարանոցային, կրծքային և գոտկային հատվածներում։ Ռեզուս մակակա կապիկների վրա կատարված փորձերը ցույց են տվել, որ առաջին ճառագայթումից հետո (44Գր) ողնուղեղի տոլերանտությունը վերականգնվում է սկզբնական չափաբաժնից մինչև 33,6Գր (76%), 37,6Գր (85%) և 44,6Գր (101%), համապատասխանաբար, 1, 2 և 3 տարի հետո [1]։ ՏՇ-ի գերազանցման պարագայում ուշ բարդությունները արտահայտվում են միելոպաթիայի տեսքով։
Հետահայաց ուսումնասիրությունը վերլուծել է միելոպաթիայի զարգացման կանխատեսիչ գործոնները ողնաշարի կրկնակի ճառագայթումով բուժվող 40 հիվանդների մոտ, որոնցից 11-ի մոտ միջինում 11 ամիս անց զարգացել է միելոպաթիա [2]։ Առաջարկվել է ռիսկի գնահատում, հիմնված 3 հիմնական պարամետրերի վրա, որոնք հանգեցնում են միելոպաթիայի ցածր ռիսկի. - ՃԲ-ի կումուլյատիվ չափաբաժինը ≤135,5Գր (կենսաբանորեն արդյունավետ չափաբաժին [Biologically Effective Dose – BED]՝ հաշվարկված α/β=2Գր ողնուղեղի պարանոցային և կրծքային հատվածների համար և α/β=4Գր գոտկային հատվածի համար),
- Երկու կուրսերի միջև 6 ամսից փոքր միջակայք,
- Յուրաքանչյուր կուրսի չափաբաժինը՝ ≤98Գր։
QUANTEC-ի ուսումնասիրությունը վերանայել է 13 կենտրոնների տվյալները, որոնք բոլորը ՃԲ կուրսերի միջև միջինում ≥6 ամսվա ընդմիջում են ունեցել [3]։ Միելոպաթիայի դեպքեր չեն գրանցվել կումուլյատիվ ≤60Գր չափաբաժնի դեպքում 2Գր համարժեք չափաբաժիններով (EQD2):
Գլխուղեղի հյուսվածքի սովորական ֆրակցիոնացմամբ կրկնակի ճառագայթման ժամանակ ռադիոնեկրոզի դեպքեր հայտնաբերվել են 100Գր-ից բարձր կումուլյատիվ չափաբաժնի պարագայում [4]։ Նեյրոտոքսիկության ուշ երևույթները հիմնականում արտահայտվում են դեմիելինիզացիայի, ռադիոնեկրոզի տեսքով։ Ռադիոնեկրոզով պայմանավորված բարդությունները հանդիսանում են լուրջ խնդիր այս պացիենտների համար։ Այս ռիսկը հիմնականում մնում է ցածր (մինչև 10%) կումուլյատիվ EQD2 100-110Գր դոզա ստացած պացիենտների մոտ, սակայն կտրուկ բարձրանում է (մինչև 25%) 130Գր և բարձր դոզաների պարագայում։
Թոքերի պատասխանը ճառագայթման նկատմամբ արտահայտվում է երկու իրար հաջորդող երևույթներով՝ պնևմոնիտի, որպես վաղ պատասխան և ուշ ֆիբրոզի տեսքով։ Թոքերի հյուսվածքի ռեիռադիացիայի ՏՇ-երի մասին կլինիկական տվյալները սահմանափակ են։ Առաջնային 60Գր (30-80Գր) ստացած՝ թոքի քաղցկեղով հիվանդներին կրկնակի 50Գր (10-70Գր) ճառագայթելու պարագայում սիմպտոմատիկ ռադիացիոն պնևմոնիտ զարգացել է 56% դեպքերում։ Սակայն այս հետազոտությունում հիվանդների միջին ապրելիությունը կազմել է 5 ամիս, ինչը բավարար ժամանակ չէ թոքերի հետճառագայթային ուշ փոփոխությունների համար [5]։
Սրտի տոլերանտության գնահատումը կրկնակի ճառագայթման նկատմամբ 9 ամիս միջակայքով փորձարկվել է առնետների վրա փորձերով, որոնցում սրտի ֆունկցիան ex vivo հետազոտվել է կրկնակի ճառագայթումից 6 ամիս անց։ Միջին տոլերանտ դոզան պայմանականորեն ընդունվել է այն դոզան, որը հանգեցնում է ֆունկցիայի կորստի բուժված կենդանիների ամենաքիչը 50%-ի մոտ (ED50): 6 ամսից քիչ միջակայքի պարագայում ED50-ը մոտ է մեկ կուրսի ED50-ին, բայց զգալի նվազում է, երբ միջակայքը 6 ամսից ավել է լինում [6]։
Երիկամները ռադիոզգայուն օրգաններից մեկն են։ Մկների, առնետների և խոզերի վրա կատարված հետազոտությունները ցույց են տալիս, որ երիկամների ճառագայթային վնասումը պրոգրեսիվում է, այլ ոչ թե վերականգնվում ժամանակի ընթացքում և երիկամների ռեզիստենտությունը կրկնակի ճառագայթման նկատմամբ ժամանակի ընթացքում չի մեծանում երկու կուրսերի միջակայքում [7]։
Միզապարկի կրկնակի ճառագայթման պարագայում փորձարարական տվյալները նույնպես ցույց չեն տվել տոլերանտության վերականգնում, ինչը հանգեցնում է միզապարկի ծավալի մոտ 50%-ի փոքրացման մկների մոտ [8]։
Ռադիոմոդիֆիկատորների համակցված կիրառումը ՃԲ-ի հետ կրկնակի կուրսի ժամանակ կարող է ավելացնել ինչպես վաղ, այնպես էլ ուշ ռադիոտոքսիկության երևույթների առաջացումը։
Առանձնահատուկ ուշադրության է արժանի կրկնակի ճառագայթման ժամանակ ֆրակցիոնացման ռեժիմների ընտրությունը։ Բազմաթիվ ռետրոսպեկտիվ վերլուծություններ և փորձարարական տվյալներ ցույց են տալիս, որ գերֆրակցիոնացված ռեժիմներն ունեն առավելություն ուշ տոքսիկության նվազեցման առումով։ Տարբեր տեղակայման ուռուցքների կրկնակի ճառագայթման վերաբերյալ կան սահմանափակ տվյալներ։
Գլուխ-պարանոցային տեղակայմամբ ուռուցքների կրկնակի ճառագայթումը սալվաժ վիրահատությունից հետո կամ առանց վիրահատության ցույց է տվել առավելություն ամոքիչ քիմիաթերապիայի նկատմամբ։ Բնականաբար կրկնակի ճառագայթման խմբում վաղ (մուկոզիտ, ֆարինգիտ) և ուշ (օստեոռադիոնեկրոզ, տրիզմ) 3-րդ և 4-րդ աստիճանի տոքսիկության դեպքերը եղել են ավելի շատ [9]։ Նորագույն մեթոդների կիրառումը, ինչպիսին է IMRT մեթոդիկան, հնարավորություն է տալիս ուռուցքի շրջանում չափաբաժնի մեծացման, հետևաբար՝ ավելի լավ տեղային հսկողության։ Բացի այդ, այս մեթոդի կիրառմամբ ռեիռադիացիայի հետ կապված մահացության դեպքերն ավելի քիչ են եղել, քան սովորական մեթոդների կիրառման պարագայում [10, 11]։ Պետք է կատարել թիրախի մանրակրկիտ ընտրություն և ուրվագծում։ Այս նպատակի համար պոզիտրոն-էմիսիոն շերտագրությունը (PET/CT) կարող է ինֆորմատիվ լինել։ Ցույց է տրվել, որ կրկնակի ճառագայթման կլինիկական թիրախային ծավալը (Clinical Target Volume – CTV) ≥50սմ3 կազմելու դեպքում հանդիսանում է 3-րդ և ավելի աստիճանի տոքսիկության հիմնական կանխատեսիչ գործոնը։ Դրան հակառակ՝ այն հիվանդները, ում մոտ CTV-ն եղել է ≤25սմ3, 3-րդ աստիճանի կամ ավելի ծանր տոքսիկության երևույթներ չեն արձանագրվել [12]։ Էական պատասխան ստանալու և հիվանդության կրկնությունը հետաձգելու համար ուռուցքն անհրաժեշտ է ճառագայթել ≥50Գր չափաբաժնով [13]։ Շատ հետազոտողներ կիրառում են 60Գր ռեիռադիացիայի թիրախային դոզան կրկնակի ճառագայթման տարբեր ուղեցույցների հիման վրա [14]։ Որոշ խոշոր վերլուծություններ ցույց են տալիս, որ ավելի բարձր ճառագայթման դոզա ստացած հիվանդների մոտ բարելավվում են ապրելիության և ուռուցքի տեղային հսկողության ցուցանիշները [15, 16]։ Ներկայումս չկա կոնսենսուս ճառագայթման ընդհանուր դոզայի և ֆրակցիոնացման տարբեր ռեժիմների ընտրության հարցում։ Սակայն ընտրված պացիենտների մոտ հնարավոր է կրկնակի ճառագայթել ուռուցքը մինչև երկրորդ ամբողջական բուժական դոզա (66-70Գր)։
Կենտրոնական նյարդային համակարգի (ԿՆՀ) տարբեր ծագման ուռուցքների կրկնկակի ճառագայթումն ընտրված հիվանդների մոտ կարող է բերել պրոգրեսիայից զերծ ապրելիության և ընդհանուր ապրելիության ցուցանիշների բարելավման։ ԿՆՀ ուռուցքներով հիվանդների ընդհանուր ապրելիությունը և առանց պրոգրեսիայի ապրելիությունը շատ տարբեր է կախված ուռուցքի հյուսվածաբանական տեսակից, հետևաբար՝ երկու կուրսերի միջև միջակայքը կարող է լինել շատ տարբեր։ Բարձր աստիճանի չարորակության գլիոմաների դեպքում կրկնակի ճառագայթման հարցը մութ է մնում, սակայն ընտրված, Կառնոֆսկու բարձր գործակցով և փոքր չափերի ուռուցքով հիվանդների համար այն կարող է լինել արդյունավետ, հատկապես եթե նախկինում եղել է ցածր աստիճանի չարորակության ուռուցք, որը վերածվել է բարձրի։ ՃԲ կուրսը պետք է կրկնել՝ օգտագործելով ժամանակակից տեխնիկա 30-35Գր 5-15 ֆրակցիաներով [17-19]։ Ախտահարված դաշտի կոնվենցիոնալ ճառագայթումը թերապևտիկ դոզաներով ինչպես առաջին անգամ ախտորոշված բարձր աստիճանի չարորակության գլիոմաների ժամանակ (54-60Գր) խորհուրդ չի տրվում հիվանդության ռեցիդիվի կրկնակի ճառագայթման պարագայում։ Ուռուցքասպան չափաբաժնին հասցնելը սահմանափակված է բուժման հետ կապված պոտենցիալ մահացու կամ ծանր տոքսիկության երևույթներով, քանի որ հիվանդների մեծամասնությունը ստացել է ադյուվանտ ՃԲ տոլերանտության առավելագույն դոզաներով առաջնային բուժման ժամանակ։ Երբեմն կարող են լինել բացառություններ եզակի հիվանդների մոտ, երբ հիվանդության կրկնությունը եղել է առաջին ՃԲ-ից 4 և ավել տարի անց, բայց նույնիսկ այս դեպքերում տոքսիկության նվազեցման համար խորհուրդ է տրվում դոզայի պակասեցում և կոնսերվատիվ ծավալի ճառագայթում։ Գլիոբլաստոմաներով հիվանդների հիվանդության ռեցիդիվի դեպքում, ինչը միջինում լինում է առաջնային բուժումից 9 ամիս անց, կրկնակի ճառագայթումը հնարավոր է և ընտրված հիվանդների մոտ պրոգրեսիայից զերծ ապրելիության մեդիանան, ըստ տարբեր կլինիկաների փորձի, կազմում է 4-6 ամիս [20, 21]։ Այնպիսի ուռուցքների պարագայում, ինչպիսիք են շվանոմաները, հեմանգիոպերիցիտոմաները, երկու ճառագայթային կուրսերի միջև միջակայքը կարող է շատ ավելի երկար լինել։ Հիվանդների ընտրության ժամանակ պետք է հաշվի առնել բոլոր հայտնի կանխատեսիչ և կանխորոշիչ գործոնները։
Գինեկոլոգիական ուռուցքների (արգանդի վզիկի, էնդոմետրիալ, հեշտոցի կամ վուլվայի քաղցկեղ) կրկնակի ճառագայթման ժամանակ հնարավոր է համակցել հեռահար ՃԲ-ն և բրախիթերապիան։ Բուժումը կարող է հետապնդել հիվանդության տեղային հսկողության հասնելու նպատակ, ինչպես նաև լինել ամոքիչ միջոց որոշ ախտանիշները (օրինակ, արյունահոսություն) դադարեցնելու համար։ Sommers et al. (1989) հետազոտությունում 376 հիվանդից 86,8%-ը ստացել է հեռահար ՃԲ, 7,7%-ը՝ հեռահար ՃԲ և բրախիթերապիա, իսկ 5,5%-ը՝ միայն բրախիթերապիա։ Կրկնակի ճառագայթման միջին դոզան կազմել է 45-50Գր։ 5-ամյա ապրելիությունը կազմել է 30% վիրահատության և ՃԲ համակցման պարագայում, միայն վիրահատության պարագայում՝ 12%, իսկ միայն ՃԲ-ի դեպքում՝ 4% [22]։ Պետք է նշել, որ վիրահատության ծավալը շատ դեպքերում լինում է էքզենտերացիան։ Բարդությունները տվյալ հետազոտությունում կազմել են 4,3% և արտահայտվել են ցիստիտի, միզուկի ստրիկտուրաների, մալաբսորբցիայի և ստորին վերջույթների լիմֆէդեմայի տեսքով։ Որոշ դեպքերում հնարավոր է նաև խուղակների առաջացում։
Ոսկրային համակարգի ցավային համախտանիշով ուղեկցվող մետաստազների կրկնակի ճառագայթումը կարող է օգտակար լինել, եթե նախնական բուժումը պատշաճ ձևով չի մեղմել ոսկրացավը կամ առաջնային դրական պատասխանից հետո զարգացել է ռեցիդիվ։ Գրականության մետավերլուծությունը ցույց է տվել, որ ոսկրային համակարգի ցավոտ մետաստազների հետ կապված պալիատիվ ՃԲ ստացած հիվանդների 20%-ը հետագայում ստացել են կրկնակի ՃԲ կուրս։ Վերջինս տվել է որոշակի օգուտ ցավի նվազեցման տեսքով 58% հիվանդների մոտ [23]։
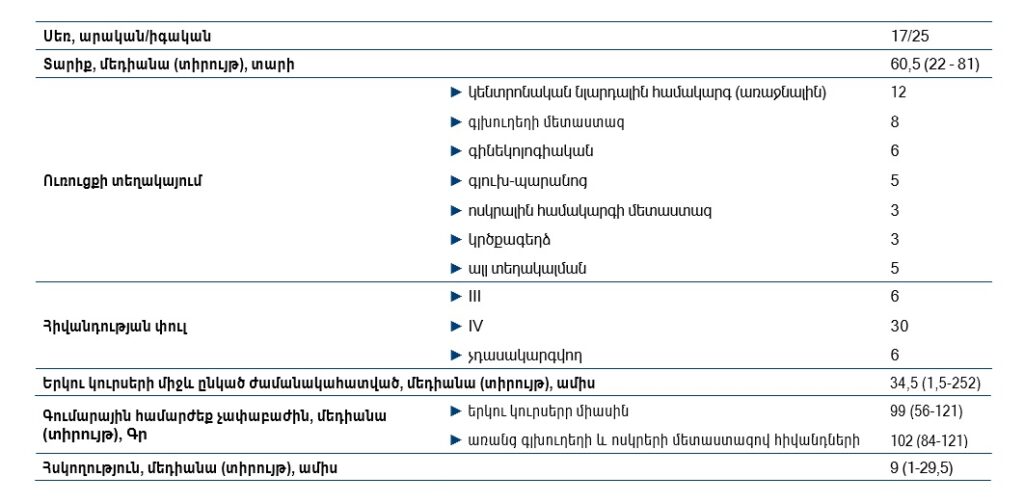
Աղյուսակ 1. Հետազոտության բնութագիրը
ՀԵՏԱԶՈՏՈՒԹՅԱՆ ՆՊԱՏԱԿԸ
Սույն պրոսպեկտիվ, միակենտրոն հետազոտության նպատակն է՝ ուսումնասիրել կրկնակի ճառագայթային բուժման նշանակման նպատակահարմարությունը տարբեր պաթոլոգիաների ժամանակ՝ վերլուծելով հիվանդների ապրելիության ցուցանիշները, հնարավոր բարդությունները և կյանքի որակը։
ՆՅՈՒԹԵՐ ԵՎ ՄԵԹՈԴՆԵՐ
Սա առաջին նմանատիպ հետազոտությունն է Հայաստանում: Այս հետազոտության մեջ ամփոփվել է մեկ առանձին կլինիկայի փորձը 1050 պացիենտների տվյալների հիման վրա, ովքեր 2019 թ. հունվարից մինչև 2021 թ. սեպտեմբեր ստացել են ՃԲ «ԻՐԱ ՄԵդիքլ Գրուպ» բժշկական կենտրոնում։ Վերլուծության համար առանձնացվել է 42 պացիենտ, ովքեր ստացել են ՃԲ կրկնակի կուրս (ռեիռադիացիա), ինչը կազմում է ընդհանուր պացիենտների 4%-ը։ Հետազոտության մեջ չեն ընդգրկվել այն հիվանդները, որոնք ողջ են եղել հոդվածի հանձնման պահին, սակայն ունեցել են կարճ հսկողություն (<3 ամիս)։ Այդ 42 հիվանդների տարիքի մեդիանան կազմել է 60,5 (տիրույթ՝ 22-81): Նրանց բաշխումն ըստ սեռի, ուռուցքի տեղակայման և հիվանդության փուլի ներկայացված է Աղյուսակ 1-ում:
Երկու կուրսերի միջև ժամանակահատվածի մեդիանան կազմել է 34,5 ամիս (տիրույթ՝ 1,5252): Երկու կուրսերի գումարային համարժեք չափաբաժնի մեդիանան կազմել է՝ 99Գր (տիրույթ՝ 56-121)։ Այս ցանկից գլխուղեղի և ոսկրային համակարգի երկրորդային ախտահարմամբ հիվանդներին բացառելու դեպքում երկու կուրսերի գումարային համարժեք չափաբաժնի մեդիանան կկազմի 102Գր (տիրույթ՝ 84-121): Հիվանդների հսկողության մեդիանան կրկնակի ՃԲ կուրսից հետո կազմել է 9 ամիս (տիրույթ՝ 1-29,5):
ՆԱԽՆԱԿԱՆ ԱՄՓՈՓՈՒՄ
Մահացած հիվանդների ապրելիության մեդիանան կազմել է 6,5 ամիս (տիրույթ՝ 1-23)։ Կրկնակի ՃԹ ստացած 42 պացիենտներից 7-ի մոտ, ովքեր ի սկզբանե ունեցել են Կառնոֆսկու ցածր գործակից (60%) ապրելիությունը կազմել է առավելագույնը 3,5 ամիս։ Եթե այս 7 պացիենտները չընդգրկվեն վիճակագրական վերլուծության մեջ, ապա հիվանդների ապրելիության մեդիանան կկազմի 10 ամիս (տիրույթ՝ 4-23)։ 2021 թ. դեկտեմբերի 31-ի դրությամբ ողջ է եղել 21 պացիենտ, որոնց հսկողության մեդիանան կազմել է 11 ամիս (տիրույթ՝ 5-29,5)։
Գնահատվել են նաև հիվանդների հետճառագայթային կյանքի որակը և բարդությունների քանակը։ Կյանքի որակի նվազեցում և բուժման հետ կապված մահվան դեպքեր չեն արձանագրվել։
Հետազոտությունն և հիվանդների հավաքագրումը շարունակվում է։
ԵԶՐԱԿԱՑՈՒԹՅՈՒՆ
Տվյալ միակենտրոն պրոսպեկտիվ հետոզոտության նախնական արդյունքները ցույց են տալիս, որ նորագույն տեխնոլոգիաներով կրկնակի ռադիոթերապիայի կուրսի միջոցով կարելի է հասնել հիվանդների ապրելիության և կյանքի որակի բարձրացման։ Անհրաժեշտ է կատարել կրկնակի ճառագայթման թեկնածուների մանրակրկիտ ընտրություն՝ հաշվի առնելով բոլոր կանխատեսիչ և կանխորոշիչ գործոններն ամեն տեղակայման ուռուցքի համար։ Նորագույն տեխնոլոգիաների շնորհիվ կարելի է պլանավորել նույնիսկ երկրորդ կուրատիվ դոզա։
ՇԱՀԵՐԻ ԲԱԽՈՒՄ
Հեղինակները չեն նշում որևէ շահերի բախման մասին։
ԳՐԱԿԱՆՈՒԹՅԱՆ ՑԱՆԿ
- Ang KK, Jiang GL, Feng Y et al. Extent and kinetics of recovery of occult spinal cord injury. Int J Radiat Oncol Biol Phys 2001;50(4):1013-1020
- Nieder C, Grosu AL, Andratschke NH, Molls M. Proposal of human spinal cord reirradiation dose based on collection of data from 40 patients. Int J Radiat Oncol Biol Phys 2005;61(3):851-855
- Kirkpatrick JP, van der Kogel AJ, Schultheiss TE. Radiation dose-volume effects in the spinal cord. Int J Radiat Oncol Biol Phys 2010;76(3S):S42-S49
- Mayer R, Sminia P. Reirradiation tolerance of the human brain. Int J Radiat Oncol Biol Phys 2008;70(5):1350-1360
- Okamoto Y, Murakami M, Yoden E, et al. Reirradiation for locally recurrent lung cancer previously treated with radiation therapy. Int J Radiat Oncol Biol Phys 2002;52(2):390396
- Wondergem J, van Ravels FJ, Reijnart IW, Strootman EG. Reirradiation tolerance of the rat heart. Int J Radiat Oncol Biol Phys 1996;36(4):811-819
- Stewart FA, Oussoren Y, Van Tinteren H, Bentzen SM. Loss of reirradiation tolerance in the kidney with increasing time after single or fractionated partial tolerance doses. Int J Radiat Biol 1994;66(2):169-179
- Stewart FA, Oussoren Y, Luts A. Long-term recovery and reirradiation tolerance of mouse bladder. Int J Radiat Oncol Biol Phys 1990;18(6):1399-1406
- Janot F, de Raucourt D, Benhamou E, et al. Randomized trial of postoperative reirradiation combined with chemotherapy after salvage surgery compared with salvage surgery alone in head and neck carcinoma. J Clin Oncol 2008;26(34):5518-5523
- Lee N, Chan K, Bekelman JE, et al. Salvage re-irradiation for recurrent head and neck cancer. Int J Radiat Oncol Biol Phys 2007;68(3):731-740
- Sulman EP, Schwartz DL, Le TT, et al. IMRT reirradiation of head and neck cancer-disease control and morbidity outcomes. Int J Radiat Oncol Biol Phys 2009;73(2):399-409
- Takiar V, Garden AS, Ma D, et al. Reirradiation of head and neck cancers with intensity modulated radiation therapy: outcomes and analyses. Int J Radiat Oncol Biol Phys 2016;95(4):1117-1131
- Salama JK, Vokes EE, Chmura SJ, et al. Long-term outcome of concurrent chemotherapy and reirradiation for recurrent and second primary head-and-neck squamous cell carcinoma. Int J Radiat Oncol Biol Phys 2006;64(2):382391
- Langendijk JA, Bourhis J. Reirradiation in squamous cell head and neck cancer: recent developments and future directions. Curr Opin Oncol 2007;19(3):202-209
- Caudell JJ, Ward MC, Riaz N, et al. Volume, dose, and fractionation considerations for IMRT-based reirradiation in head and neck cancer: a multi-institution analysis. Int J Radiat Oncol Biol Phys 2018;100(3):606-617
- Choe KS, Haraf DJ, Solanki A, et al. Prior chemoradiotherapy adversely impacts outcomes of recurrent and second primary head and neck cancer treated with concurrent chemotherapy and reirradiation. Cancer 2011;117(20):46714678
- Straube C, Kessel KA, Zimmer C, et al. A Second course of radiotherapy in patients with recurrent malignant gliomas: clinical data on re-irradiation, prognostic factors, and usefulness of digital biomarkers. Curr Treat Options Oncol 2019;20(9):71
- Shi W, Scannell Bryan M, Gilbert MR, et al. Investigating the effect of reirradiation or systemic therapy in patients with glioblastoma after tumor progression: a secondary analysis of NRG Oncology/Radiation Therapy Oncology Group Trial 0525. Int J Radiat Oncol Biol Phys 2018;100(1):38-44
- Scoccianti S, Francolini G, Carta GA, et al. Re-irradiation as salvage treatment in recurrent glioblastoma: A comprehensive literature review to provide practical answers to frequently asked questions. Crit Rev Oncol Hematol 2018;126:80-91
- Howard SP, Krauze A, Chan MD, Tsien C, Tomé WA. The evolving role for re-irradiation in the management of recurrent grade 4 glioma. J Neurooncol 2017;134(3):523530
- Bartsch R, Weitmann HD, Pennwieser W, et al. Retrospective analysis of re-irradiation in malignant glioma: a single-center experience. Wien Klin Wochenschr 2005;117(23-24):821-826
- Sommers GM, Grigsby PW, Perez CA, et al. Outcome of recurrent cervical carcinoma following definitive irradiation. Gynecol Oncol 1989;35(2):150-155
- Huisman M, van den Bosch MA, Wijlemans JW, van Vulpen M, van der Linden YM, Verkooijen HM. Effectiveness of reirradiation for painful bone metastases: a systematic review and meta-analysis. Int J Radiat Oncol Biol Phys. 2012;84(1):8-14