Լյարդաբջջային քաղցկեղի վիրահատական բուժումը դռներակի հազվադեպ արատով հիվանդի մոտ
Խաչատուր Վ. Բադալյան, Անժելա Ա. Տոնոյան
Իզմիրլյան բժշկական կենտրոն, Երևան, Հայաստան
Վիրաբուժության և նորարարական վիրաբուժական տեխնոլոգիաների ամբիոն, ակադ. Ս. Ավդալբեկյանի անվան Առողջապահության ազգային ինստիտուտ, Երևան, Հայաստան
ԱՄՓՈՓԱԳԻՐ
Լյարդաբջջային քաղցկեղը լյարդի ամենատարածված չարորակ ուռուցքն է (դեպքերի մոտ 90%), որը ծագում է հեպատոցիտներից: Այն բնութագրվում է ագրեսիվ ընթացքով, բարդությունների և մահացության բարձր մակարդակով։ Կանխատեսումը ծայրաստիճան անբարենպաստ է՝ 5-ամյա ապրելիությունը չի գերազանցում 30%-ը։ Հոդվածում նկարագրվում է 64-ամյա տղամարդու լյարդաբջջային քաղցկեղի բուժման կլինիկական դեպք՝ դռներակի հազվագյուտ արատով։ Կատարվել է աջակողմյան հեմիհեպատէկտոմիա, խոլեցիստէկտոմիա, ստոծանու գմբեթի հարթահատում և աջ մակերիկամի հարթահատում։
Հիմնաբառեր. լյարդաբջջային քաղցկեղ, դռներակ, զարգացման արատ, հեմիհեպատէկտոմիա
DOI:10.54235/27382737-2022.v2.1-63
ВВЕДЕНИЕ
Первичный рак печени – это злокачественный процесс, берущий свое начало непосредственно из клеток печени и желчных путей. По статистике по сравнению с метастатическими поражениями печени первичный рак этого органа встречается в 30 раз реже. Патология примерно в 3 раза чаще поражает мужчин, чем женщин, имеет общемировую тенденцию к росту за последние 10 лет. Гепатоцеллюлярный рак (ГЦР) – наиболее часто встречающаяся патология (около 90% случаев) среди злокачественных опухолей печени, исходящих из гепатоцитов [1]. Реже встречается холангиоцеллюлярный рак – злокачественная опухоль, исходящая из эпителия внутрипеченочных желчных протоков, смешанные гепатохолангиокарциномы, фиброламеллярная карцинома.
ГЦР – 6-й по распространенности рак в мире, с более чем 840 тыс. новых случаев заболевания ежегодно, занимает 4-е место по смертности от онкологических заболеваний во всем мире (более 780 тыс. смертей ежегодно) [1-3]. Предполагаемый прогноз на выживаемость при раке печени зависит от запущенности онкологического процесса и возрастных особенностей пациента. При первой и второй стадии в результате хирургического вмешательства и успешного удаления опухоли 5-летняя выживаемость составляет 80%. На последних этапах патологии прогноз, как правило, неблагоприятный. Например, при 3-й стадии до рубежа в 5 лет доживает до 30 % пациентов. На 4-й стадии эта цифра ещё скромнее — менее 20% лиц удаётся дожить до 3 лет. При отсутствии терапевтической помощи рак печени развивается агрессивно. Смерть человека наступает спустя 6 и менее месяцев после постановки диагноза [5].
С развитием гепатохирургии, на сегодняшний день, отработана методология проведения практически бескровных операций даже при значительных поражениях, учитывая технические сложности выполнения обширных резекций, особенно при врастании опухоли в сосудистые структуры ворот печени, в нижнюю полую вену и в печеночные вены. Принципиальным считается предоперационное изучение особенностей хода и разветвлений артериальных и венозных структур.
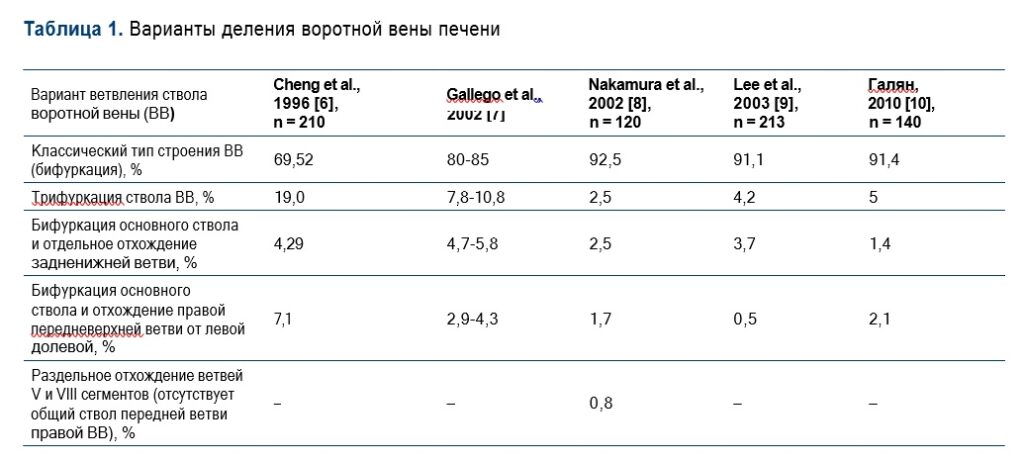
Существуют различные классификации вариантов деления воротной вены. Y. Cheng и соавт. [6] предложили классификацию, основанную на оценке вариантов формирования правой ветви воротной вены, анализируя варианты деления при ангиографии у 210 человек. C. Gallego и соавт. [7], S. Lee и соавт. [9] и Т.Н. Галян [10] на основании анализа данных, полученных в ходе исследований, подтвердили данные Y. Cheng и соавт. [6]. T. Nakamura и соавт. [8] у 120 родственных доноров на основании анализа данных комплексного ультразвукового исследования (УЗИ) и мультиспиральной компьютерной томографии (МСКТ) с контрастированием на дооперационном этапе при родственной трансплантации правой доли печени выявили еще один тип строения, при котором наблюдается раздельное отхождение сегментарных ветвей к V и VIII сегментам (Рис. 1).
Частота вариантов деления ствола воротной вены представлена в Таблице 1.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
В декабре 2021 года в медицинский центр “Измирлян” поступил мужчина 64 лет с жалобами на тупые боли и чувство тяжести в правом подреберье, тошноту, потерю массы тела и необъяснимое ухудшение состояния со слабостью. Считал себя больным на протяжении 1,5 месяцев, когда после перенесенной острой респираторной вирусной инфекции почувствовал боли в области живота. УЗИ органов брюшной полости выявило объемное образование печени и спленомегалию.
По данным КТ органов брюшной полости – объемное образование в правой доле печени, признаки внутрипеченочного масс-эффекта (фиброламеллярная гепатоцеллюлярная карцинома под вопросом), без метастатических поражений и признаков лимфаденопатии. За счет сдавления опухолевым образованием определялось высокое стояние диафрагмы (Рис. 2). В венозной фазе была выявлена анатомическая особенность в воротной системе: воротная вена разделилась на латеральную ветвь, которая кровоснабжает 6 и 7 сегменты, далее ствол продолжался и делился на парамедианную, кровоснабжающую 5 и 8 сегменты, и левую ветви воротной вены (Рис. 3; тип C на Рис. 1).
Вследствие ухудшения состояния спустя месяц, пациент обратился в медицинский центр “Измирлян”, был госпитализирован с целью проведения планового оперативного вмешательства в виде правосторонней гемигепатэктомии (ПГГЭ). На момент поступления по данным лабораторных исследований: HBsAg 8144 COI (при положительном результате, начиная с 1 COI), альфа-фетопротеин (АФП) >10.000 МЕ/мл (при норме ≤ 5,8) и высоком показателе С-реактивного белка (16,89 при норме <5).
На основании имеющихся данных был поставлен диагноз: хронический гепатит В, объемное образование правой доли печени.
В связи с необходимостью проведения обширной резекции печени и наличием хронического гепатита В, важным является оценка состояния оставшейся паренхимы левой доли печени. С этой целью было проведено гистологическое исследование неизмененной паренхимы. Заключение: хронический гепатит, METAVIR A2 (умеренная активность), F1 (портальный и перипортальный фиброз).
Была проведена ПГГЭ в плановом порядке. В первую очередь по принятой методологии были обработаны воротные структуры: пересечена и лигирована правая ветвь собственной печеночной артерии, проведена мобилизация холедоха с последующей холецистэктомией, после чего визуализировалась воротная вена (Рис. 4).
С учетом анатомических особенностей, был пересечен правый печеночный проток, что позволило сместить холедох медиально, после чего можно было визуализировать все ветви воротной вены (Рис. 5).
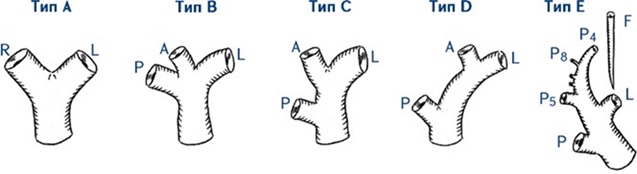
Рис. 1. Анатомические варианты деления воротной вены (ВВ) по T. Nakamura и соавт.[8].
Тип A – бифуркация ВВ; тип B – трифуркация ВВ (отсутствует общий ствол правой ВВ); тип C – раздельное экстрапаренхиматозное отхождение задней и передней ветвей правой ВВ; тип D – раздельное отхождение задней и передней ветвей ВВ, передняя ветвь отходит интрапаренхиматозно; тип E – раздельное отхождение ветвей V и VIII сегментов (отсутствует общий ствол передней ветви правой ВВ).
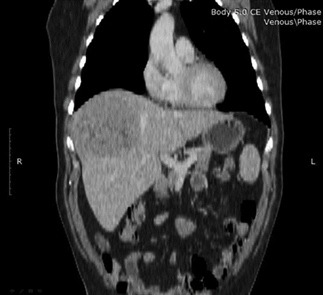
Рис. 2. Венозная фаза КТ пациента, коронарная проекция. Высокое стояние диафрагмы за счет давления опухолевым образованием.
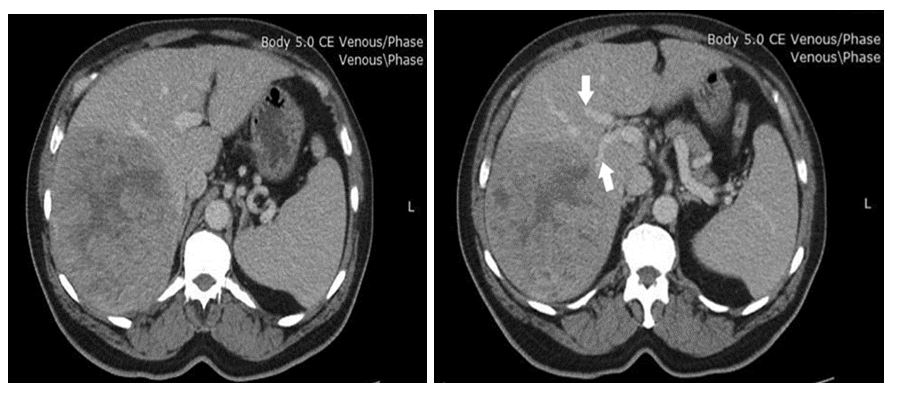
Рис. 3. Венозная фаза КТ пациента, аксиальная проекция. Верхней стрелкой обозначена левая ветвь воротной вены. Нижней обозначена латеральная (задненижняя) ветвь, отходящая отдельно до бифуркации основного ствола. Визуализируется также спленомегалия.
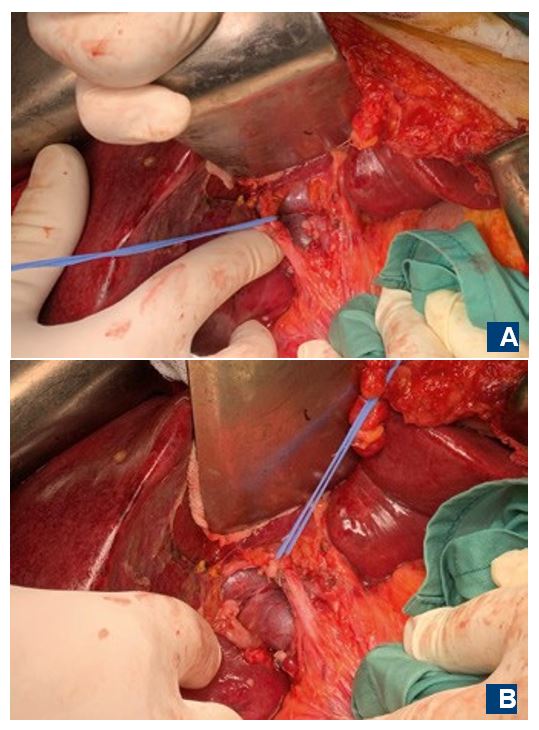
Рис. 4. Интраоперационно. Ствол воротной вены, культя пересеченной правой ветви собственной печеночной артерии, пересеченный пузырный проток и холедох на держалке. Ветвь, которая идет поперек ствола в левую долю, и часть ветви, идущей в правую (А). Но при ревизии было обнаружено, что до этого участка от ствола отделялась еще одна ветвь, идущая в правую долю (В).
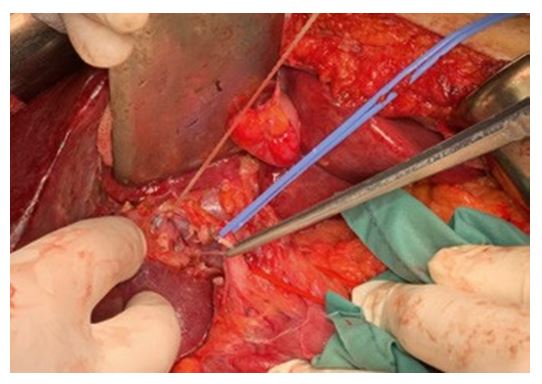
Рис. 5. Интраоперационно. На держалке – холедох, видны ствол воротной вены, лигированные латеральная (лигатура взята пинцетом) и парамедианная ветви. На этом фоне видна линия демаркации (темная паренхима правой доли и светлая – левой).
Только после обработки воротных структур была мобилизована правая доля печени. Проведена плоскостная резекция диафрагмы в связи с большим объемом опухолевого поражения печени и врастанием в купол диафрагмы. Было выявлено врастание в правый надпочечник, в связи с чем проведена плоскостная резекция надпочечника. После этого была проведена ПГГЭ по линии демаркации (Рис. 6 и 7). Объем кровопотери: 500 мл.
Послеоперационный период осложнился реактивным плевритом. Последнее осложнение встречается в 15-25% случаев после гемигепатэктомии. Генез реактивного плеврита неотъемлемо связан с травматизацией диафрагмы при выполнении операции на печени [13].
Была проведена плевральная пункция справа с удалением 500 мл прозрачной жидкости без запаха, назначены диуретики и антибактериальная терапия. В ходе динамического исследования повторного накопления жидкости в плевральной полости не наблюдалось.
На 17-е сутки пациент был выписан в удовлетворительном состоянии.
ОБСУЖДЕНИЕ
Наиболее значительным фактором риска для ГЦР является цирроз (около 80% случаев).
Основными причинами развития цирроза (при которых происходит повреждение печени), а следовательно, и ГЦР являются в том числе и вирусные гепатиты В и С [11]. Результаты более десятка проспективных когортных исследований показали, что хроническая инфицированность HBV в 100 и более раз повышает риск развития ГЦР. Причинная связь между HCV и раком печени была подтверждена выявлением РНК HCV в опухолевых клетках. [4]. Но надо учитывать, что не все пациенты с циррозом подвержены равному риску развития ГЦР, и ГЦР не всегда встречается у пациентов с циррозом. Помимо цирроза, с повышенным риском связаны и другие факторы, которые включают в себя принадлежность к мужскому полу, пожилой возраст, постоянное повышение уровня аланинаминотрансферазы, повышение уровня АФП и постепенное нарушение функции печени. Менее 10% случаев ГЦР развивается в здоровой ткани печени [12]. Учитывая этиологические факторы, сформировался определенный контингент скрининга (УЗИ, определение уровня АФП), в том числе больные гепатитом В, С, D, циррозом печени и т.д.
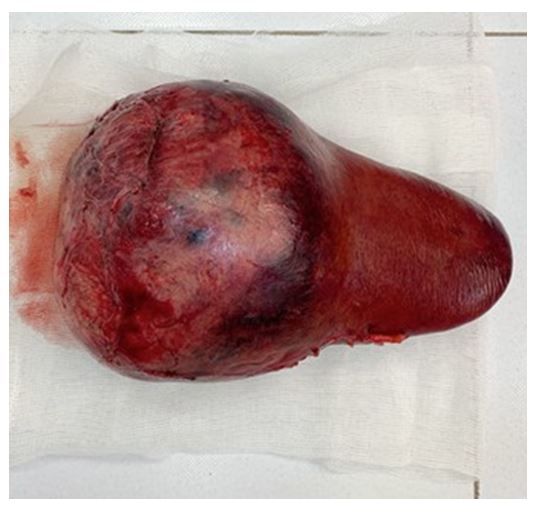
Рис. 6. Удаленный материал. 30х20 cм.
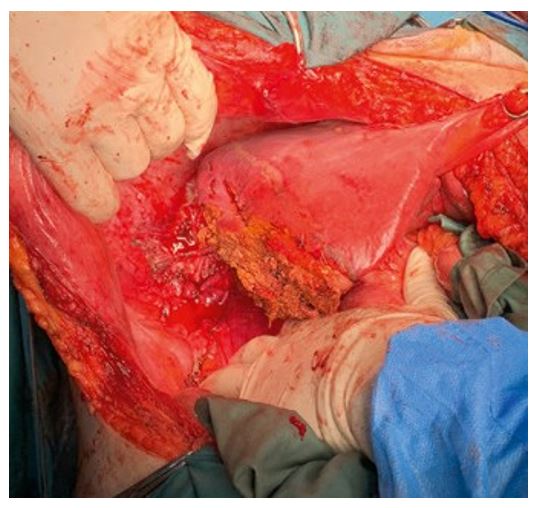
Рис. 7. Оставшаяся левая доля печени.
Кроме скрининга, основными моментами являются: определение объема опухоли и ее локализации, объем оставшейся части и ее функциональное состояние, отношение опухоли к сосудам, выявление увеличенных лимфатических узлов и отдаленных метастазов, а также верификация опухоли (например, пункционная биопсия).
Для осуществления концепции диагностики ГЦР проводят УЗИ, КТ с внутривенным контрастированием, морфологическую верификацию биоптата из опухоли.
Лечение ГЦР должно быть комбинированным: сочетаются химиотерапия и хирургические методы, среди которых выделяют три основных метода: резекция печени, трансплантация печени (при циррозе и нарушении функции печени) и локальные методы (радиочастотная абляция, химиоабляция [этанолом или раствором уксусной кислоты], которые применяются преимущественно при размерах опухоли не более 4 см, криодеструкция). У каждого из данных методов имеются свои показания и противопоказания, и выбор проводится с учетом ряда факторов, которые определяются на этапе диагностики, в том числе учитываются размер и локализация опухоли, состояние пациента.
На сегодняшний день основным является анатомическая резекция, выполнение которой стало возможным в связи с развитием методологии современной гепатохирургии, что уменьшило риск развития осложнений и объем кровопотерь. При этом принципиальным является соблюдение этапов проведения обширных резекций печени: обработка воротных структур, лигирование структур удаляемой части, в глиссоновых воротах, мобилизация и лигирование печеночной вены с соответствующей стороны [14].
ЛИТЕРАТУРА
- Bray F, Ferlay J, Soerjomataram I et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424
- Forner A, Reig M, Bruix J. Hepatocellular carcinoma. Lancet. 2018;391:1301-1314
- GLOBOCAN 2020 Cancer Fact Sheet. www.globocan. iarc.fr (accessed Jan 2021)
- Рак печени или печеночноклеточный (гепатоцеллюлярный) рак печени (С22) Доступно на: http://www. oncology.ru/specialist/epidemiology/malignant/C22/
- Онкология. Под ред. Чиссова ВИ, Дарьяловой СЛ. Москва: ГЭОТАР-Медиа, 2007. 560 с.
- Cheng YF, Huang TL, Lee TY et al. Variation of the intrahepatic portal vein: angiographic demonstration and application in living-related hepatic transplantation. Transplant Proc. 1996;28:1667-1668
- Gallego C, Velasco M, Marcuello P et al. Congenital and acquired anomalies of the portal venous system. RadioGraphics. 2002;22:141-159
- Nakamura T, Tanaka K, Kiuchi T et al. Anatomical variations and surgical strategies in right lobe living donor liver transplantation: lessons from 120 cases. Transplantation. 2002;73:1896-1903
- Lee SG, Hwang S, Kim KH et al. Approach to anatomic variations of the graft portal vein in right lobe living-donor liver transplantation. Transplantation. 2003;75(3S):S28-32
- Галян ТН. Ангиоархитектоника и билиарная анатомия печени родственного донора по данным мультиспиральной компьютерной томографии и магнитно-резонансной томографии: Автореф. дис. канд. мед. наук. М 2010.
- Marrero JA, Kulik LM, Sirlin CB et al: Diagnosis, staging and management of hepatocellular carcinoma: 2018 practice guidance by the AASLD. Hepatology. 2018;68(2):723-750
- Bruix J, Reig M, Sherman M: Evidence-based diagnosis, staging, and treatment of patients with hepatocellular carcinoma. Gastroenterology. 2016;50(4):835-853
- Дзидзава ИИ, Слободяник АВ, Ионцев ВИ. Осложнения после обширных резекций печени. Вестник Российской Военно-Медицинской Академии. 2015;3(51):262-263
- Лекции по гепатопанкреатобилиарной хирургии. Под ред. Гальперина ЭИ, Дюжевой ТГ. Москва: Видар-М, 2011:260-269