ՆԵՐԱԾՈՒԹՅՈՒՆ
Բրախիթերապիան կամ կոնտակտային ճառագայթային բուժումը ճառագայթային բուժման հիմնարար մեթոդներից մեկն է, որը կարող է կիրառվել ինչպես առանձին, այնպես էլ հեռահար ճառագայթային բուժման հետ համակցված [1]: «Բրախի» հունարեն նշանակում է կարճ այստեղից էլ անվանումը՝ բրախիթերապիա՝ բուժում կարճ տարածության վրա (բառացիորեն՝ կարճաբուժություն): Մեթոդի գլխավոր առավելությունն այն է, որ հնարավորություն է ընձեռում ճառագայթման առավելագույն դոզա հասցնել և կենտրոնացնել ուռուցքի հատվածում՝ ուռուցքը շրջապատող հարակից հյուսվածքները և օրգանները հնարավորինս պահպանելով ավելորդ ճառագայթումից: Բրախիթերապևտիկ բուժման ժամանակ ռադիոակտիվ աղբյուրը ժամանակավորապես կամ մշտապես ներդրվում է բուն ուռուցքի կամ դրան շատ մոտ տարածության վրա: Ըստ տեղակայման տարբերում են բրախիթերապիայի հետևյալ տեսակները՝
- Ներխոռոչային
- Ներհյուսվածքային
- Վիրահատական
- Անոթային (պսակաձև զարկերակներ)
- Ներլուսանցքային
- Միկրոգնդային
- Մակերեսային
- Մամմոսայտ (կրծքային):
Ամենատարածվածը ներխոռոչային տեսակն է, որը լայնորեն կիրառվում է կանանց սեռական օրգանների ուռուցքների դեպքում: Բրախիթերապիան ներկայումս ունի մեծ տարածում ամբողջ աշխարհում և լայնորեն կիրառվում է արգանդի վզիկի, շագանակագեղձի, կերակրափողի, ուղիղ աղիքի, լեզվի, գլխուղեղի և այլ տեղակայումների քաղցկեղի բուժման ժամանակ:
1895 թ. նոյեմբերի 8-ին գերմանացի ականավոր ֆիզիկոս Վիլհելմ Ռենտգենի կողմից հայտնագործվեցին ռենտգենյան ճառագայթները և սկսվեցին լայնածավալ հետազոտություններ՝ ուղղված դրանց ֆիզիկական հատկությունների, կենդանի օրգանիզմների հետ փոխազդեցության մեխանիզմների բացահայտմանը: Մեկ տարի անց՝ 1896 թ. Ֆրանսիացի ֆիզիկոս Անրի Բեքերելը (նկ. 1) հայտնագործեց բնական ռադիոակտիվության երևույթը: 1898 թ. Կյուրի ամուսինները (նկ. 2) ուսումնասիրելով ուրանի հանքանյութը հայտնագործեցին ռադիումի (226Ra) և պոլոնիումի (209Po) ռադիոակտիվ իզոտոպները: Ռադիոակտվիության և ռադիոակտիվ իզոտոպների հայտնաբերումից կարճ ժամանակ անց Պիեռ Կյուրին ենթադրեց, որ այս իզոտոպները կարելի է կիրառել քաղցկեղի բուժման համար:
Պատրաստելով ապակե խողովակից ռադիում պարունակող ապլիկատորներ` Բեքերելն ու Կյուրին սկսեցին ուսումնասիրել ռադիումի կենսաբանական ազդեցությունը մաշկի վրա: 1901 թ. Կյուրի ամուսինները 0.398 մգ պարունակությամբ ռադիումի սուլֆատով սրվակը փոխառության տվեցին փարիզցի բժիշկներ Ալեքսանդր Դանլոսին և Պոլ Բլոխին՝ գայլախտի և չարորակ նորագոյացությունների բուժման համար [2]:
1903 թ. Բեքերելը և Կյուրի ամուսիններն արժանացան ֆիզիկայի Նոբելյան մրցանակի ռադիոակտիվության երևույթի հայտնագործման համար: Նույն թվականին Նյու Յորքում բժիշկ Մարգարետ Քլիվսը կատարեց արգանդի վզիկի անվիրահատելի քաղցկեղի առաջին ներխոռոչային բուժումը՝ 700 մգ ռադիումի բրոմիդով [3]: 1905 թ. Ամերիկացի վիրաբույժ Ռոբերտ Աբբեն (Նյու Յորք) կատարեց ռադիումի պատիճների հետվիրահատական ներպատվաստում (իմպլանտացիա):
1906 թ. Փարիզում հիմնադրվեց «Ռադիումի կենսաբանական լաբորատորիա»:
1909 թ. Ֆրանսիացի ուրոլոգ Օկտավ Պաստոն և «ռադիումաբույժ» Պոլ-Մարի Դեգրեն առաջարկեցին ռադիումի պատիճների իմպլանտացիա միզածորանի միջոցով՝ շագանակագեղձի քաղցկեղի բուժման համար [4]:

Նկար 1. Անտուան Անրի Բեքերել

Նկար 2. Պյեռ Կյուրի և Մարիա Սկլոդովսկա-Կյուրի
Նույն թվականին Մարիա Սկլադովսկա-Կյուրին Փարիզում հիմնեց «Ռադիումի ինստիտուտը»՝ ռադիոակտիվության և իոնացնող ճառագայթների կենսաբանական ազդեցությունն ուսումնասիրելու նպատակով: Լիոնցի բժիշկ Կլավդիոս Ռեգոն «Ռադիումի ինստիտուտի» գիտնականների և հետազոտողների հետ համատեղ մշակեց ռադիումի կիրառման մի շարք մեթոդներ, այդ թվում որպես վիրաբուժական մասնահատումներին այլընտրանք:
1909 թ. Լուի-Ֆրեդերիկ Վիքհեմը և ՊոլՄարի Դեգրեն հրատարակեցին ռադիումաբուժությանը նվիրված առաջին գիրքը, որը շատ արագ թարգմանվեց և տարածվեց գիտական հանրության շրջանում [5]:

Նկար 3. Ռոլֆ Զիվերտ

Նկար 4. Ֆրեդերիկ և Իրեն Ժոլիո-Կյուրի
1910 թ. Բրյուսելում 1 գ ռադիումի տրոհման ակտիվության միավորն ի պատիվ Կյուրի ամուսինների կոչվեց կյուրի (կարճ կի կամ Ci):
1911 թ. Մարիա Սկլադովսկա-Կյուրիին շնորհվեց երկրորդ Նոբելյան մրցանակը, այս անգամ՝ «քիմիայի բնագավառում առաջընթացի համար, որ տեղի ունեցավ երկու քիմիական տարրերի՝ ռադիումի և պոլոնիումի հայտնագործման, ինչպես նաև մաքուր ռադիումի ստացման և այդ կարևոր տարրի բնույթի ու բաղադրության ուսումնասիրման համար»:
Ռադիումի հայտնագործումը հիմք դրեց մեծաթիվ բժշկագիտական և կլինիկական հետազոտությունների իրականացմանը՝ առաջարկելով բուժման նոր և ավելի արդյունավետ մեթոդներ: Սակայն ռադիումի գործնական կիրառումն առաջացնում էր մի շարք բարդություններ՝ պայմանավորված այդ տարրի սահմանային շատ ցածր ակտիվությամբ (ակտիվության հարաբերակցությունը զանգվածին) և կիսատրոհման շատ երկար ժամանակով (1600 տարի): Մասնավորապես շագանակագեղձի քաղցկեղի բուժման դեպքում բուժական չափաբաժինն ուռուցքին հասցնելը պահանջում էր 1 շաբաթ և կիրառվում էին բավականին հաստ ռադիումական ասեղներ: Ռադիումական ասեղները 1 շաբաթ մնում էին բաց վերքի մեջ, ինչը կարող էր հանգեցնել ծանր հետևանքների՝ այտուց, բորբոքում, վարակակիր մանրէների ներթափանցում և այլն [6]: Այս խնդրի լուծման համար առաջարկվեց ռադիումը փոխարինել ռադոն (222Rn) քիմիական տարրով, որը դեռևս 1900 թ. հայտնագործվել էր գերմանացի ֆիզիկոս Ֆրիդրիխ Դորնի կողմից: Ռադոնն առաջանում է ռադիումի տրոհումից և ի տարբերություն ռադիումի ունի մեծ սահմանային ակտիվություն և կիսատրոհման կարճ ժամանակ (3.825 օր): 1 Կի ակտիվությամբ ռադոնը թեև գազ է, բայց գրավում է մինչև 1 մմ3 ծավալ, ինչը հնարավորություն տվեց պատրաստել ավելի բարակ ասեղներ իմպլանտացիայի նպատակով [7]: Սակայն մաքուր՝ առանց ավելորդ հավելումների ռադոնի ստացումը բավականին ծախսատար էր և կապված տեխնիկական մեծ դժվարությունների հետ: Այդ պատճառով էլ շատ երկրներում ռադոնի կիրառումը լայն տարածում չգտավ:
1915 թ. առաջին անգամ ԱՄՆ-ում ուրոլոգ Բենջամին Բարինջերը 3 սմ երկարությամբ 50100 մԿի ակտիվությամբ ռադոնի ասեղներ կիրառեց շագանակագեղձի քաղցկեղի բուժման ժամանակ՝ հիմք դնելով ներհյուսվածքային ճառագայթային թերապիային [8]:
1920-ական թվականներին ճառագայթաբանության նկատմամբ հետաքրքրությունը այնքան մեծ էր, որ աշխարհի տարբեր երկրներում հիմնադրվեցին գիտահետազոտական կենտրոններ, կլինիկաներ և լաբորատորիաներ: Արժանի է հիշատակման շվեդ մեծանուն ռադիոֆիզիկոս Ռոլֆ Զիվերտը (նկ. 3), որը 19241937 թթ. գլխավորել է շվեդական «Ռադիումի տուն» ֆիզիկական լաբորատորիան, որտեղ հետազոտություններ են իրականացվել քաղցկեղի ոչ վիրահատական բուժման և ճառագայթային թերապիայի կիրառման ուղղությամբ։ Հաշվի առնելով նրա հեղափոխական ներդրումը՝ քաղցկեղի ախտորոշման ու բուժման ժամանակ օգտագործվող իոնացնող ճառագայթների չափաբաժինների չափման և գնահատման աշխատանքներում՝ 1979 թ.՝ Չափման միավորների XVI գլխավոր գիտաժողովի ժամանակ, Զիվերտի պատվին նրա անունով կոչվեց Միավորների միջազգային համակարգի արդյունավետ ու համարժեք իոնացնող ճառագայթման չափաբաժնի չափման միավորը. զիվերտ՝ նշանակվելով Զվ (Sv):
1930-ական թվականներին Էդվարդ Քուիմբին և Ռալստոն Պատերսոնը մշակեցին բուժման առաջին դոզաչափական համակարգերը՝ ներխոռոչային բրախիթերապիայի համար [9-11]:
1934 թ. Ֆրեդերիկ և Իրեն Ժոլիո-Կյուրի ամուսինները (նկ. 4) հայտնաբերեցին արհեստական ռադիոակտիվության երևույթը: Նրանք ապացուցեցին, որ ատոմները կայուն չեն և կարող են փոխակերպվել այլ քիմիական հատկություններով օժտված նոր ատոմների: Այս հայտնագործությունը հեղափոխական նշանակություն ունեցավ՝ հնարավորություն տալով ստանալ և կիրառել այլ ռադիոակտիվ նուկլիդներ բրախիթերապիայում: Ներկայումս գոյություն ունեն հազարից ավելի ռադիոնուկլիդներ, որոնց մի մասը լայնորեն կիրառվում է ճառագայթային թերապիայում:
1940-ականների վերջին մի շարք ռադիոիզոտոպներ՝ ինչպիսիք են կոբալտ-60 (60Co), ոսկի198 (198Au), տանտալ-182 (182Ta) և ցեզիում-137 (137Cs) սկսեցին լայնորեն կիրառվել ներխոռոչային ճառագայթային թերապիայում՝ աստիճանաբար փոխարինելով ռադիումին:
1958 թ. Բժիշկ Ուլրիխ Հենշկեն առաջին անգամ Մեմորիալ-Սլոան Քեթթերինգ քաղցկեղի կենտրոնում (ԱՄՆ) կիրառեց իրիդիում-192 (192Ir) ռադիոնուկլիդը՝ փոխարինելով վերը թվարկված ռադիոնուկլիդներին [12]: 1960 թ. բժիշկ Հենշկեն՝ արգանդի վզիկի քաղցկեղի ներխոռոչային բուժման համար նկարագրեց հիվանդների ճառագայթվող հատված ռադիոնուկլիդի հետբեռնման ավտոմատացված տեխնիկան (afterloading technique), ինչը թույլ տվեց՝ նվազեցնել բուժանձնակազմի ճառագայթահարման արդյունարար դոզան:
1960-ական թվականներին շագանակագեղձի բուժման համար սկսեցին լայնորեն կիրառվել ոսկու-198 և յոդի-125 ռադիոնուկլիդները՝ մշտական իմպլանտի տեսքով (ռադիոնուկլիդը օրգանիզմում մնում է ցմահ):
1970-ական թվականներին ներկայացվեց դոզիմետրիկ հսկողության «Փարիզյան համակարգը», որը հստակ նկարագրում էր իրիդիում-192 ռադիոնուկլիդի կիրառման կանոնները
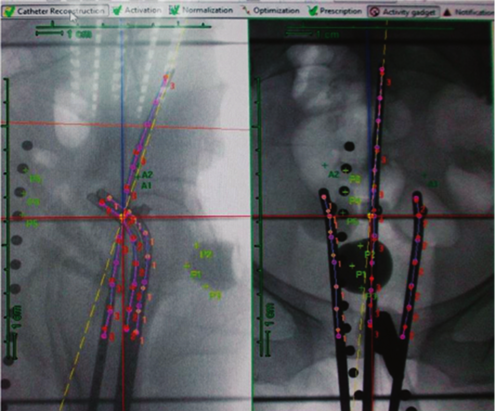
Նկար 5. Բուժման երկչափ (2D) պլանավորում
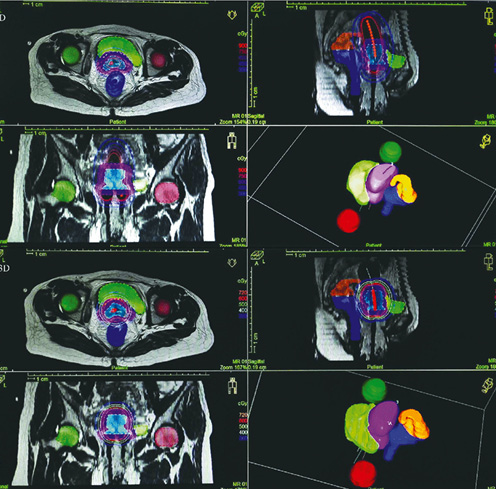
Նկար 6. Բուժման եռաչափ (3D) պլանավորում
բրախիթերապիայում [13-15]: Այս թվականներին աշխարհում մեծ թափով զարգանում էին նաև ախտորոշիչ մեթոդները՝ նպաստելով առկա ճառագայթային բուժման մեթոդների կատարելագործմանը: 1980-ական թվականներին մշակվեցին և ներդրվեցին շագանակագեղձի քաղցկեղի բուժման նոր մեթոդներ և ընթացակարգեր [16]: Ճառագայթաբան Ալվարո Մարտինեսն առաջարկեց կիրառել շագանակագեղձի քաղցկեղի համակցված բուժում՝ բրախիթերապիա և հեռահար ճառագայթային թերապիա
[17]: 1983 թ. Դանիացի ուրոլոգ Հանս-Հենրիկ Հոլմը ներկայացրեց յոդ-125 ռադիոնուկլիդի մշտական իմպլանտացիայի ընթացակարգն անմիջականորեն շագանակագեղձի մեջ՝ ուլտրաձայնային տեսապատկերման հսկողությամբ՝
ապահովելով իմպլանտների դիրքի և տեղի ճշգրտությունը [18]:
Տարիներ շարունակ բրախիթերապևտիկ բուժման պլանավորումն իրականացվում էր ռենտգենագրական պատկերների հիման վրա: Ապլիկատորների տեղադրումից հետո արվում էր երկու ռենտգենյան լուսանկար և իրականացվում էր բուժման հետագա պլանավորումը: Այս մեթոդն ընդունված է անվանել բուժման 2D կամ երկչափ պլանավորում (նկ. 5): Հաշվի առնելով բուժման երկչափ պլանավորման ժամանակ ճառագայթման դոզայի բաշխման գնահատման սահմանափակ և ոչ լիարժեք հնարավորությունները՝ առաջարկվեց կիրառել դոզայի բաշխման և գնահատման «Մանչեսթերյան համակարգը»: Այս համակարգը երկար տարիներ կիրառվում էր արգանդի վզիկի քաղցկեղի բուժման ժամանակ: Ճառագայթման միավորների և չափումների միջազգային հանձնախմբի (International Commission on Radiation Units and Measurements, ICRU) կողմից այս նպատակով հրապարակվեց ICRU 38 զեկույցը, որը հստակ սահմանում էր արգանդի վզիկի քաղցկեղի դեպքում ուռուցքին և հարակից օրգաններին (մասնավորապես միզապարկին և ուղիղ աղիքին) բաժին ընկնող ճառագայթման դոզայի մեծությունները [19]:
1990-ական թվականներին բրախիթերապևտիկ բուժման մեթոդների օպտիմալացմանը և կատարելագործմանը նպաստեցին նաև ախտորոշիչ սարքավորումների լայն կիրառությունը՝ համակարգչային շերտագրություն, մագնիսառեզոնանսային շերտագրություն, պոզիտրոն-էմիսիոն շերտագրություն: Այս մեթոդները հնարավորություն տվեցին իրականացնել բուժման 3D կամ եռաչափ պլանավորում (նկ. 6): Եռաչափ մեթոդի կիրառումը հնարավորություն տվեց ճառագայթման չափաբաժինն առավելագույնս հասցնել ուռուցքին՝ միևնույն ժամանակ նվազագույնի հասցնելով առողջ հարակից հյուսվածքներին բաժին ընկնող դոզան: Ի տարբերություն բուժման երկչափ պլանավորման, եռաչափ պլանավորումը հնարա-
վորություն տվեց կիրառել ավելի լայն գործիքակազմ՝ տեսապատկերման համակարգերի օգնությամբ ճշգրիտ որոշել ուռուցքի տեղակայումը և սահմանները, հստակ սահմանել ուռուցքի և հարակից օրգանների երկրաչափական կառուցվածքը և չափերը, բարդ մաթեմատիկական մոդելների օգնությամբ ապահովել դոզայի համաչափ տարածական բաշխումը և այլն: Բրախիթերապևտիկ բուժման եռաչափ պլանավորումը ներկայումս լայն կիրառում ունի ամբողջ աշխարհում և համարվում է բուժման ոսկե ստանդարտ, իսկ բուժման ընթացակարգերը ներկայացված են ICRU 89 զեկույցում [20]:
ԵԶՐԱԿԱՑՈՒԹՅՈՒՆ
Վերը շարադրվածից ակնհայտ է դառնում, որ բրախիթերապիան հեռահար ճառագայթային թերապիայի հետ մեկտեղ հանդիսանում է չարորակ նորագոյացություններով հիվանդների բուժման հիմնարար և արդյունավետ մեթոդ: Այն կարող է կիրառվել ինչպես առանձին, այնպես էլ համակցված եղանակով: Այն ապահովում է բուժման 80-90% արդյունավետություն մի շարք տեղակայումների մասնավորապես՝ իգական սեռական օրգանների, շագանակագեղձի և մաշկի քաղցկեղի դեպքում: Ունենալով ստեղծման և կիրառման ավելի քան 120ամյա պատմություն՝ բրախիթերապիան այսօր էլ լայնորեն կիրառվում է ամբողջ աշխարհում: Ներկայումս կատարվում են մեծ թվով գիտահետազոտական աշխատանքներ և կլինիկական փորձարկումներ՝ բրախիթերապևտիկ բուժման նոր և առկա մեթոդների ներդրման ու կատարելագործման նպատակով: Բրախիթերապիայի շարունակական զարգացմանը նպաստում են նաև վերջին տարիներին քիմիայի և միջուկային ֆիզիկայի բնագավառում կատարված հայտնագործությունները՝ նոր ռադիոնուկլիդների հայտնագործումը, նանոմասնիկային հիմքով արհեստական միացությունների սինթեզը և այլն:
ԳՐԱԿԱՆՈՒԹՅԱՆ ՑԱՆԿ
- Brucer M. Brachytherapy. Am J Roentgenol Radium Ther Nucl Med. 1958;79(6):1080-90
- Pierquin, B., Wilson, J.F., Chassagne, D. Modern brachytherapy. NY: Masson Publishing USA; 1987. p. 2542
- Aronowitz JN, Aronowitz SV, Robison RF. Classics in brachytherapy: Margaret Cleaves introduces gynecologic
- brachytherapy. Brachytherapy. 2007;6(4):293-7
- Pasteau O, Degrais. [The employment of radium in the treatment of prostate cancer] [in French]. J Urologie Med Chirur 1913;4:341-66
- Wickham L, Degrais P. Radiumtherapie. Bailliere. Paris; 1909
- Cade S. Radium Treatment of Cancer. New York, NY: William Wood; 1929
- Failla G. The physics of radium. In: Clark JG, Norris CC, editors. Radium in Gynecology Philadelphia, PA: JB Lippincott; 1927. p. 63
- Barringer BS. The treatment by radium of carcinoma of the prostate and bladder. JAMA. 1916;67:1442-5
- Quimby EH. The grouping of radium tubes in packs and plaques to produce the desired distribution of radiation. Am J Roentgenol and Rad. Ther. 1932;27:18-39
- Paterson R, Parker H. A dosage system for gamma ray therapy. 1934. Br J Radiol. 1934;7(82):592-632
- Paterson R, Parker H. A dosage system for interstitial radium therapy. Br J Radiol. 1938;11(124):252-66
- Henschke U, Hilaris B, Mahan G. Afterloading in interstitial and Intracavitary radiation therapy. Am J Roentgenol Radium Ther Nucl Med. 1963;90(8):386-95
- Chassagne D, Raynal M, Pierquin B. Technic of endocurietherapy by iridium 192 with plastic tubes in the breast tumors. [Article in French]. J Radiol Electrol Med Nuc.l 1963;44:269-71
- Pierquin B, Chassagne D, Chahbazian CM, Wilson JF. Brachytherapy. W.H. Green, editor. St Louis, Missouri; 1978
- Dutreix A, Marinello G, Pierquin B, Chassagne D, Houlard JP. [Recent developments in the Paris System. Part two:
- devices called “in triangles” (author’s transl)] [in French]. J Radiol. 1979;60(5):319-25
- Sylvester J, Blasko JC, Grimm P, Ragde H. Interstitial implantation techniques in prostate cancer. J Surg Oncol. 1997;66(1):65-75
- Martinez A, Edmundson GK, Cox RS et al. Combination of external beam irradiation and multiple-site perineal applicator (MUPIT) for treatment of locally advanced or recurrent prostatic, anorectal, and gynecologic malignancies. Int J Radiat Oncol Biol Phys. 1985;11(2):391-8
- Holm HH, Juul N, Pedersen JF et al. Transperineal 125iodine seed implantation in prostatic cancer guided by transrectal ultrasonography. J Urol. 1983;130(2):283-6
- Chassagne D, Dutreix A, Almond P et al. International Commission on Radiation Units and Measurements (ICRU). Dose and volume specification for reporting intracavitary therapy in gynecology. ICRU Report 38. ICRU, Bethesda, MD; 1985
- Prescribing, Recording, and Reporting Brachytherapy for Cancer of the Cervix. J ICRU. 2013;13(1-2):doi:10.1093/
jicru/ndw027